
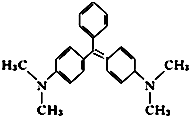
 孔雀石绿是化工产品,具有较高毒性,高残留,容易致癌、致畸. 其结构简式如图所示.下列关于孔雀石绿的说法正确的是( )
孔雀石绿是化工产品,具有较高毒性,高残留,容易致癌、致畸. 其结构简式如图所示.下列关于孔雀石绿的说法正确的是( )| A. | 孔雀石绿的分子式为C23H25N2 | |
| B. | 孔雀石绿属于芳香烃 | |
| C. | 孔雀石绿苯环上的一氯取代物有5种 | |
| D. | 1mol孔雀石绿在一定条件下最多可与6 mol H2发生加成反应 |
分析 A.根据结构数出分子中C原子、H原子、N原子个数,写出分子式;
B.含有N元素,不属于烃;
C.含有2个苯环,根据对称结构分析;
D.孔雀石绿的分子中含有2个苯环和3个C=C键.
解答 解:A.孔雀石绿的分子中含有23个C原子、26个H原子、2个N原子,故分子式为C23H26N2,故A错误;
B.含有N元素,不属于烃,属于烃的衍生物,故B错误;
C.孔雀石绿苯环上共有3+2种H原子,如图所示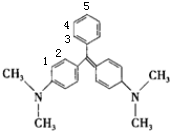 ,孔雀石绿苯环上的一氯取代物有5种,故C正确;
,孔雀石绿苯环上的一氯取代物有5种,故C正确;
D.孔雀石绿的分子中含有2个苯环和3个C=C键,2mol苯环共与6mol氢气发生加成反应,3molC=C能与3mol氢气发生加成反应,则1mol孔雀石绿在一定条件下最多可与9molH2发生加成反应,故D错误.
故选C.
点评 本题考查有机物的结构和性质,题目难度中等,本题易错点为A和C,注意分子式的判断以及等效氢原子的判断.


 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案科目:高中化学 来源: 题型:解答题
| X | ||
| Y | ||
| Z |
 ;一种由B、C组成的化合物与AC2互为等电子体,其化学式为N2O.
;一种由B、C组成的化合物与AC2互为等电子体,其化学式为N2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只要是甜的物质,都是糖类 | |
| B. | 单糖是不能发生水解的最简单的糖类 | |
| C. | 淀粉纤维素都是天然有机高分子化合物 | |
| D. | 蔗糖和麦芽糖均为二糖 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 汽油是含有C5~C11的烷烃,可以通过石油的分馏得到汽油 | |
| B. | 含C18以上烷烃的重油经过催化裂化可以得到汽油 | |
| C. | 取等质量的乙烯和聚乙烯完全燃烧后,生成的CO2和H2O的质量分别相等 | |
| D. | 煤含有苯和甲苯,可用先干馏后分馏的方法将它们分离出来 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol | B. | 0.15mol | C. | 0.25mol | D. | 0.3mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 除去乙烷中少量的乙烯:光照条件下通入Cl2,使乙烯转化成液态二氯乙烷而与乙烷分离 | |
| B. | 除去乙醇中少量的乙酸:加足量生石灰,蒸馏 | |
| C. | 除去CO2中少量的SO2:气体通过盛饱和碳酸钠溶液的洗气瓶 | |
| D. | 除去乙酸乙酯中少量的乙酸:用氢氧化钠溶液洗涤,分液、干燥、蒸馏 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 名称 | 甲醇 | 二甲胺 | 二甲基甲酰胺 | 甲醚 | 碳酸二甲酯 |
| 结构式 | CH3OH | (CH3)2NH | (CH3)2NCHO | CH3OCH | (CH3O)2CO |
| 沸点(℃) | 64.7 | 7.4 | 153℃ | -24.9 | 90℃ |
| 容器编号 | 温度/℃ | 起始物质的量/mol | 平衡物质的量/mol | |
| CH3OH | CH3OCH3 | H2O | ||
| Ⅰ | 387 | 0.20 | x | |
| Ⅱ | 387 | 0.40 | y | |
| Ⅲ | 207 | 0.20 | 0.090 | 0.090 |
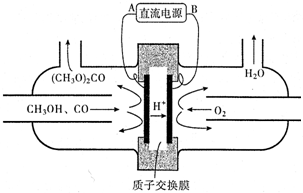
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com