
| A. | 汽油 | B. | 化学式为C2H6O的物质 | ||
| C. | 聚乙烯 | D. | 化学式为CH2Cl2的物质 |
分析 纯净物是由一种物质组成的物质,混合物是由多种物质组成的物质;据此结合常见物质的组成成分逐项分析即可.
解答 解:A.汽油主要是由C4~C10各族烃类组成,是混合物,故A错误;
B.C2H6O有乙醇和二甲醚等同分异构体,不一定是纯净物,故B错误;
C.乙烯发生加聚反应生成聚乙烯,由于聚合度n不同,故聚乙烯为混合物,故C错误;
D.化学式为CH2Cl2的物质只有一种结构是二氯甲烷结构,不存在同分异构体,一定是纯净物,故D正确;
故选D.
点评 本题考查了纯净物和混合物的区别,解答本题要充分理解纯净物和混合物的区别,要分析物质是由几种物质组成的,如果只有一种物质组成就属于纯净物,如果有多种物质就属于混合物,题目较简单.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | MnO2吸收SO2的反应:MnO2+SO2═MnSO4 | |
| B. | MnO2作为碱性电池正极材料时的放电反应:MnO2+e-+H+═MnOOH | |
| C. | MnSO4与KMnO4反应制备MnO2:2MnO4-+3Mn2++2H2O═5MnO2+4H+ | |
| D. | 尾气中的SO2 还可用足量的氨水吸收:SO2+2NH3•H2O═2NH4++SO32-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该烃能使溴水褪色 | B. | 该烃有三种不同的物质 | ||
| C. | 该烃的一氯取代物4种 | D. | 该烃的二氯取代物6种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
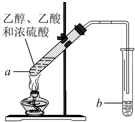 红葡萄酒密封储存时间越长,质量越好,原因之一是储存过程中生成了有香味的酯.在实验室也可以用如下图所示的装置制取乙酸乙酯,请回答下列问题.
红葡萄酒密封储存时间越长,质量越好,原因之一是储存过程中生成了有香味的酯.在实验室也可以用如下图所示的装置制取乙酸乙酯,请回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③④⑥⑦⑧ | B. | ②③④⑦ | C. | ③④⑤⑥⑦⑧ | D. | ③④⑦⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碘和干冰的升华 | B. | 二氧化硅和生石灰的熔化 | ||
| C. | 氯化钠和铁的熔化 | D. | 干冰和氯化铵变成气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 1 | ① | ② | ||||||
| 2 | ③ | ④ | ⑤ | ⑥ | ⑦ | |||
| 3 | ⑧ | ⑨ | ⑩ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com