
【题目】盐酸与碳酸钙反应生成CO2,运用下图,可测定该反应的速率.请根据要求填空:

(1)连接好仪器后,需要检查_____________________,再加入药品进行实验.
(2)在锥形瓶中加入5g大理石,加入20mL 1mol·L1盐酸.每隔10s观测玻璃注射器中气体的体积,并以mL·s1为反应速率的单位,计算每10s时间间隔内的反应速率。数据处理的结果见下面的表格:
时间/s | 10 | 20 | 30 | 40 | 50 | 60 |
气体体积/mL | 4 | 14 | 25 | 38 | 47 | 55 |
反应速率/mL·s1 | 0.4 | 1.0 | 1.1 | ? | 0.9 | 0.8 |
表格中的“?”处应填的数据是_________________.
(3)从反应速率随时间变化的数据可知,本实验中反应速率与___________和__________有关
【答案】装置气密性 1.3 溶液温度 H+的浓度
【解析】
(1)根据气体体积测反应速率,应保证装置不漏气;
(2)以mLs-1为反应速率的单位,每10s时间间隔内的反应速率:v=![]() ;
;
(3)根据浓度、温度对反应速率的影响进行分析。
(1)根据气体体积测反应速率,应保证装置不漏气,所以实验前要检查装置气密性;
(2)由表中数据可知30s—40s之间的10s内收集到的气体体积为38-25=13mL,所以该10s内的反应速率为13mL÷10s=1.3 mL·s1;
(3)从表中的数据得到的结论是:反应速率随时间推移,先小后大,最后又变小;该反应放热,随反应进行,温度升高,所以反应速率加快,由于盐酸浓度降低,所以最后反应速率减慢,所以本实验中反应速率与溶液温度和H+的浓度有关。


 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源: 题型:
【题目】一种利用钛铁矿制备Li4Ti5O12的工艺流程如图:

已知:钛铁矿的主要成分是FeTiO3(可表示为FeO·TiO2),还含有少量的MgO和SiO2等杂质。
回答下列问题:
(1)酸浸时,要提高铁的浸出率可采取的措施是___(写出一条即可)。
(2)酸浸后的滤液①中钛主要以TiOCl42-形式存在,则其水解生成TiO2·xH2O的离子方程式为___,加热水的目的是___。
(3)TiO2·xH2O沉淀与双氧水、氨水反应时,应将温度控制在50℃左右的原因是___。
(4)若将滤液②加热至一定温度后,再加入双氧水和磷酸,恰好使Mg2+沉淀完全[溶液中c(Mg2+)降至1.0×10-5mol·L-1],此时溶液中![]() =___。已知:此温度下,FePO4、Mg3(PO4)2的溶度积常数分别为1.5×10-21、1.0×10-23。
=___。已知:此温度下,FePO4、Mg3(PO4)2的溶度积常数分别为1.5×10-21、1.0×10-23。
(5)高温煅烧时发生反应的化学反应方程式为___。
(6)某可充电的锂离子电池以Li4Ti5O12为正极,嵌入锂的碳材料为负极,含Li+导电固体为电解质。放电时的电池反应为LixC+Li4Ti5O12=Li(x-5)C+Li9Ti5O12,则充电时阴极电极反应式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化钛在一定波长光的照射下,可有效降解甲醛、苯等有机物,效果持久,且自身对人体无害。某课题组研究了溶液的酸碱性对TiO2光催化染料R降解反应的影响,结果如图所示。下列判断正确的是

A. 在0~50 min之间,R的降解百分率pH=2大于pH=7
B. 溶液酸性越强,R的降解速率越大
C. R的起始浓度不同,无法判断溶液的酸碱性对R的降解速率的影响
D. 在20~25 min之间,pH=10时R的降解速率为0.04 mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】10 ℃加热NaHCO3饱和溶液,测得该溶液的pH发生如下的变化:
温度(℃) | 10 | 20 | 30 | 加热煮沸后冷却到50 ℃ |
pH | 8.3 | 8.4 | 8.5 | 8.8 |
(1)甲同学认为,该溶液的pH升高的原因是HCO3-的水解程度增大,故碱性增强,该水解反应的离子方程式为______________。
(2)乙同学认为,溶液pH升高的原因是NaHCO3受热分解,生成了Na2CO3,并推断Na2CO3的水解程度________(填“大于”或“小于”)NaHCO3,该分解反应的化学方程式为____。
(3)丙同学认为甲、乙的判断都不充分。丙认为:
①只要在加热煮沸的溶液中加入足量的试剂BaCl2溶液,若产生沉淀,则乙判断正确。原因是____________(写出反应的离子方程式)。能不能选用Ba(OH)2溶液?______(答“能”或“不能”)。
②将加热后的溶液冷却到10 ℃,若溶液的pH________(填“大于”“小于”或“等于”)8.3,则________(填“甲”或“乙”)判断正确。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2的排放会带来全球“温室”效应,因此,引起国际关注和研究,渴望21世纪 CO2将作为新碳源被广泛使用。
(1)以 CO2 和 H2 为原料可得到 CH4 燃料。
已知:① CH4 (g) + CO2(g) = 2CO(g) + 2H2(g) △ H1= + 247kJ·mol-1
② CH4 (g) + H2O(g) = CO(g) + 3H2(g) △ H2= + 205kJ·mol-1
写出由 CO2 获得CH4的热化学方程式:_____。
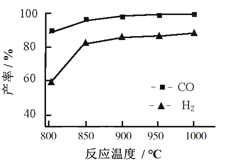
(2)CO2与CH4经催化重整可制得合成气:CH4(g)+CO2(g) = CO(g)+2H2(g) 按一定体积比加入CH4和CO2,在恒压下发生反应,温度对CO和H2产率影响如图所示。此反应优选温度为900℃的原因是______________________。
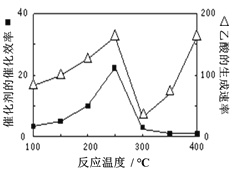
(3)以二氧化钛表面覆盖的Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸。
① 催化剂的催化效率与乙酸的生成速率随温度的变化关系如上图所示。250~300℃时,温度升高而乙酸的生成速率降低的原因是__________________。
② 为了提高该反应中CH4的转化率,可以采取的措施是________(写出两种) 。
③ 将Cu2Al2O4溶解在稀硝酸中离子方程式是________________________。
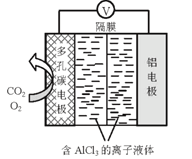
(4)O2辅助的Al—CO2电池工作原理如上图所示。该电池电容量大,能有效利用CO2,电池反应产物Al2(C2O4)3是重要的化工原料。电池的负极反应式:_______________________。电池的正极反应式:2CO2+2e= C2O42该过程中,O2起催化作用,催化过程可表示为:i: 6 O2 + 6e = 6 O2 ii: ……写出ii的离子方程式:______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】.实验室要配制240mL 0.2mol·L-1的Na2CO3溶液,试回答下列各题:
(1)若用Na2CO3固体配制溶液,下列仪器中,不需要用到的是______________。
A.锥形瓶 B.200mL容量瓶 C.烧杯 D.胶头滴管
E.药匙 F.托盘天平 G.洗瓶 H.试剂瓶
(2)若要实施配制,除上述仪器外,尚缺的必须的仪器是________________________。
(3)需要称量Na2CO3固体的质量是____________________________ 。
(4)下列四项操作会导致所得溶液浓度偏高的是__________。
a.容量瓶不干燥
b.定容时俯视容量瓶刻度线
c.称量Na2CO3固体时物体和砝码放反了(1克以下用游码)
d.定容后,把容量瓶倒置摇匀后发现液面低于刻度线,便补充几滴水至刻度处
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤、石油、淀粉都是基础的化工原料,它们之间存在如下关系(部分产物和反应条件未标出)。B为相对分子质量为28的烃;E为淀粉水解的最终产物;F分子中含有一个甲基和一个羧基,lmolF与足量的钠反应能生成标况下22.4LH2;D物质中也含有羧基。

回答下列各题:
(1)若A为煤焦油,则从A中分离出苯的方法是__________,工业上通过石油的________制B物质.
(2)C为乙苯,则苯和B生成C的反应类型是____________, C的结构简式是____________.
(3)写出B制备聚乙烯的反应方程式_____________________________________________.
(4)写出D与F转化为G的反应方程式________________________________________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究不同 pH 时 CuSO4 溶液对 H2O2 分解的催化作用。资料:a.Cu2O 为红色固体,难溶于水,能溶于硫酸,生成 Cu 和Cu2+。b.CuO2 为棕褐色固体,难溶于水,能溶于硫酸,生成 Cu2+和 H2O2。c.H2O2 有弱酸性:H2O2 ![]() H+ +HO2-,HO2-
H+ +HO2-,HO2- ![]() H+ +O22-。
H+ +O22-。
编号 | 实验 | 现象 |
Ⅰ | 向 1 mL pH=2 的 1 mol·L 1 CuSO4溶液中加入 0.5 mL 30% H2O2 溶液 | 出现少量气泡 |
Ⅱ | 向 1 mL pH=3 的 1 mol·L 1 CuSO4溶液中加入 0.5 mL 30% H2O2 溶液 | 立即产生少量棕黄色沉淀,出现较明显气泡 |
Ⅲ | 向 1 mL pH=5 的 1 mol·L 1CuSO4溶液中加入 0.5 mL 30% H2O2 溶液 | 立即产生大量棕褐色沉淀,产生大量气泡 |
(1) 经检验生成的气体均为 O2,Ⅰ中 CuSO4 催化分解 H2O2 的化学方程式是__。
(2)对Ⅲ中棕褐色沉淀的成分提出 2 种假设:ⅰ.CuO2,ⅱ.Cu2O 和CuO2 的混合物。为检验上述假设,进行实验Ⅳ:过滤Ⅲ中的沉淀,洗涤,加入过量硫酸,沉淀完全溶解,溶液呈蓝色,并产生少量气泡。
①若Ⅲ中生成的沉淀为 CuO2,其反应的离子方程式是__。
②依据Ⅳ中沉淀完全溶解,甲同学认为假设ⅱ不成立,乙同学不同意甲同学的观点,理由是__。
③为探究沉淀中是否存在 Cu2O,设计如下实验:
将Ⅲ中沉淀洗涤、干燥后,取 a g 固体溶于过量稀硫酸,充分加热。冷却后调节溶液 pH,以 PAN 为指示剂,向溶液中滴加 c mol·L 1EDTA 溶液至滴定终点,消耗 EDTA 溶液 V mL。V=__,可知沉淀中不含 Cu2O,假设ⅰ成立。(已知:Cu2++EDTA= EDTA-Cu2+,M(CuO2)=96 g·mol 1,M(Cu2O)=144 g·mol1)
(3)结合方程式,运用化学反应原理解释Ⅲ中生成的沉淀多于Ⅱ中的原因__ 。
(4)研究Ⅰ、Ⅱ、Ⅲ中不同 pH 时 H2O2 分解速率不同的原因。
实验Ⅴ:在试管中分别取 1 mL pH=2、3、5 的 1 mol·L1 Na2SO4 溶液,向其中各加入 0.5 mL 30% H2O2 溶液,三支试管中均无明显现象。
实验Ⅵ:__(填实验操作和现象),说明 CuO2 能够催化 H2O2 分解。
(5)综合上述实验,Ⅰ、Ⅱ、Ⅲ中不同 pH 时 H2O2 的分解速率不同的原因是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验的反应原理及对应的离子方程式均正确的是
A.室温下测得氯化铵溶液pH<7,证明一水合氨是弱碱:NH4++H2O![]() NH3·H2O+H+
NH3·H2O+H+
B.用氢氧化钠溶液除去镁粉中的杂质铝:2Al+2OH-=2AlO2-+H2↑
C.用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:2MnO4-+6H++5H2O2=2Mn2++5O2↑+8H2O
D.用酸性高锰酸钾标准溶液滴定草酸:2MnO4-+16H++5C2O42-=2Mn2++10CO2↑+8H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com