
| A. | 萃取操作必须在分液漏斗中进行 | |
| B. | 振荡试管中液体时,手拿住试管,用手腕甩动 | |
| C. | 用剩的药品应收集起来放回原试剂瓶中 | |
| D. | 称量物质时先取小砝码,再依次取较大的砝码 |
分析 A.萃取可用固相萃取装置;
B.振荡试管中液体时,要防止液体飞溅;
C.一般剩余的药品不能放回原试剂瓶,防止试剂污染;
D.称量时,选择砝码先大后小.
解答 解:A.萃取操作时,为防止倒出的液体不纯,两种溶剂必须从不同开口倒出,且必须容易控制倒出液体的量,但萃取操作不一定非要在分液漏斗中进行,萃取可用固相萃取装置,则可混合均匀后在普通漏斗中进行,故A错误;
B.为防止液体溅出,震荡试管中液体时,手拿住试管,用手腕甩动,故B正确;
C.剩余药品可能沾有其它物质被污染,导致剩余药品放回原瓶会污染试剂瓶中的药品,所以不能放回原瓶,但特殊药品如Na等需要放回原瓶,故C错误;
D.称量药品时,砝码的添加顺序为:先取大砝码,再依次取较小的砝码,故D错误;
故选B.
点评 本题考查化学实验方案的评价,为高频考点,把握实验基本操作、基本技能为解答的关键,侧重分析与实验能力的考查,注意仪器及操作的应用,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| 物质 | 熔点(℃) | 沸点(℃) | 密度(g•cm-3) | 水中溶解度 |
| 甲 | -98 | 57.5 | 0.93 | 可溶 |
| 乙 | -84 | 77 | 0.90 | 可溶 |
| A. | 蒸馏法 | B. | 升华法 | C. | 萃取法 | D. | 过滤法 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
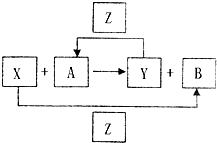 X、Y、Z为三种常见的单质,Z为绿色植物光合作用后的产物之一,A、B为常见的化合物.它们在一定条件下可以发生如图所示的转化关系(均不是在溶液中进行的反应)以下每空中填入一种即可).
X、Y、Z为三种常见的单质,Z为绿色植物光合作用后的产物之一,A、B为常见的化合物.它们在一定条件下可以发生如图所示的转化关系(均不是在溶液中进行的反应)以下每空中填入一种即可).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1s22s22p63s1→1s22s22p6 | |
| B. | N≡N(g)→N(g)+N(g) | |
| C. | 2p${\;}_{x}^{2}$2p${\;}_{y}^{1}$2p${\;}_{z}^{1}$→2p${\;}_{x}^{1}$2p${\;}_{y}^{1}$2p${\;}_{z}^{2}$ | |
| D. | 2H(g)→H-H(g) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
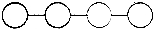
| A. | 若单体是4种氨基酸.则该化合物为四肽.其彻底水解后的产物再重新组合成四肽,共有24种排列方式 | |
| B. | 若单体是葡萄糖,则该化合物不能与斐林试剂发生特定的颜色反应 | |
| C. | 若单体是4种脱氧核苷酸,则该化合物彻底水解的产物是4个脱氧核糖、4个磷酸和4种碱基(A、O、G、C) | |
| D. | 若单体是4种核苷酸,则初步水解该化合物需要3个水分子. |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com