
| A. | 稀醋酸与0.1 mol•L-1NaOH反应:H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ•mol-1 | |
| B. | 密闭容器中,9.6 g硫粉与11.2 g铁粉混合加热充分反应,放出19.12 kJ热量.则Fe(s)+S(s)═FeS(s)△H=-95.6 kJ•mol-1 | |
| C. | 已知1 mol氢气完全燃烧生成液态水所放出的热量为285.5 kJ,则水分解的热化学方程式:2H2O(l)═2H2(g)+O2(g)△H=+285.5 kJ•mol-1 | |
| D. | 已知2C(s)+O2(g)═2CO(g)△H=-221 kJ•mol-1,则可知C的燃烧热△H=-110.5 kJ•mol-1 |
分析 A.醋酸为弱酸,电离吸热;
B.n(S)=$\frac{9.6g}{32g/mol}$=0.3mol,n(Fe)=$\frac{11.2g}{56g/mol}$=0.2mol,发生Fe(s)+S(s)═FeS(s),0.2molFe完全反应放出19.12 kJ热量,则1molFe完全反应放出热量为95.6kJ;
C.1 mol氢气完全燃烧生成液态水所放出的热量为285.5 kJ,物质的量与热量成正比,相反过程反应的焓变数值相同、符号相反;
D.1molC完全燃烧生成二氧化碳时的热量为燃烧热.
解答 解:A.醋酸为弱酸,电离吸热,则CH3COOH(l)+OH-(aq)═H2O(l)+CH3COO-(aq)△H>-57.3 kJ•mol-1,故A错误;
B.n(S)=$\frac{9.6g}{32g/mol}$=0.3mol,n(Fe)=$\frac{11.2g}{56g/mol}$=0.2mol,发生Fe(s)+S(s)═FeS(s),0.2molFe完全反应放出19.12 kJ热量,则1molFe完全反应放出热量为95.6kJ,则热化学方程式为Fe(s)+S(s)═FeS(s)△H=-95.6 kJ•mol-1,故B正确;
C.1 mol氢气完全燃烧生成液态水所放出的热量为285.5 kJ,物质的量与热量成正比,相反过程反应的焓变数值相同、符号相反,则水分解的热化学方程式:H2O(l)═H2(g)+$\frac{1}{2}$O2(g)△H=+285.5 kJ•mol-1,故C错误;
D.1molC完全燃烧生成二氧化碳时的热量为燃烧热,则由2C(s)+O2(g)═2CO(g)△H=-221 kJ•mol-1,不能确定C的燃烧热,故D错误;
故选B.
点评 本题考查热化学方程式,为高频考点,把握中和热、燃烧热及热化学方程式的书写为解答的关键,侧重分析与应用能力的考查,注意选项D为解答的难点,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 2Cu+O2?2CuO | B. | CH4+2O2 $\frac{\underline{\;点燃\;}}{\;}$ CO2+2H2O | ||
| C. | 2KClO3?2KCl+3O2↑ | D. | CaCO3+2HCl═CaCl2+H2O+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
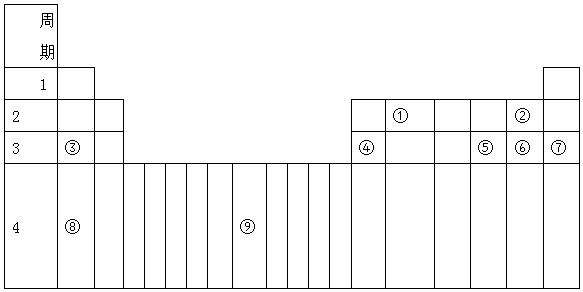
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
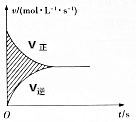 在容积为4L的刚性密闭容器中,进行可逆反应:X(g)+2Y(g)?2Z(g)并达到平衡,在此过程中以Y的浓度改变表示的反应速率v正、v逆与时间t的关系如图所示,则图中阴影部分的面积表示( )
在容积为4L的刚性密闭容器中,进行可逆反应:X(g)+2Y(g)?2Z(g)并达到平衡,在此过程中以Y的浓度改变表示的反应速率v正、v逆与时间t的关系如图所示,则图中阴影部分的面积表示( )| A. | X的浓度的变化量 | B. | Y的浓度的减小量 | ||
| C. | Z的物质的量的变化量 | D. | Y的物质的量的减小量 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
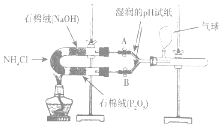 某实验小组利用如图装置验证NH4 C l受热分解时的分解产物为氨气和氯化氢.
某实验小组利用如图装置验证NH4 C l受热分解时的分解产物为氨气和氯化氢. 查看答案和解析>>
科目:高中化学 来源: 题型:解答题
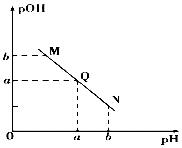 现有①0.1mol/L NaOH溶液和②0.1mol/L HX溶液.
现有①0.1mol/L NaOH溶液和②0.1mol/L HX溶液.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2:71 | B. | 71:2 | C. | 1:8 | D. | 8:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 全部 | B. | ①②③⑤⑥ | C. | ①③⑤⑥ | D. | ③⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,22.4 L CO2中含有NA个CO2分子 | |
| B. | 1.7 g H2O2中含有的电子数为0.9NA | |
| C. | 标准状况下,2.24 L乙醇含有的分子数等于0.1NA | |
| D. | 分子数为NA的CO、C2H4混合气体体积约为22.4 L,质量为28 g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com