
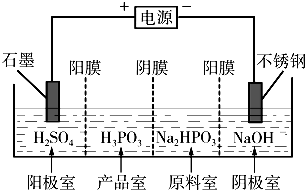
 (2013?济宁二模)亚磷酸(H3PO3)是二元酸,H3PO3溶液存在电离平衡:H3PO3?H++H2PO3-.亚磷酸与足量NaOH溶液反应,生和Na2HPO3.
(2013?济宁二模)亚磷酸(H3PO3)是二元酸,H3PO3溶液存在电离平衡:H3PO3?H++H2PO3-.亚磷酸与足量NaOH溶液反应,生和Na2HPO3.| c(H+).C(H2PO3-) |
| C(H3PO3) |
| c(H+)?c(H2PO3-) |
| c(H3PO3) |
| 2.5×10-2×2.5×10-2 |
| 0.10-2.5×10-2 |
| 0 | -3 |


 名校联盟快乐课堂系列答案
名校联盟快乐课堂系列答案 黄冈创优卷系列答案
黄冈创优卷系列答案科目:高中化学 来源: 题型:
(2013?济宁二模)下列陈述Ⅰ、Ⅱ正确并且有因果关系的是( )
|
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com