
| 元素代号 | A | B | C | D | E |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.099 | 0.074 |
| 主要化合价 | +2 | +3 | +6,-2 | -1 | -2 |
 .
.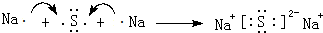 .
.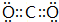 ,该分子的结构式为O=C=O.
,该分子的结构式为O=C=O.分析 F原子中无中子,所以是H;G最高正价数与负价数相等,且最外层电子数是次外层的二倍,则G是C元素;H元素单质焰色反应呈黄色,则H为Na;C、E都有-2价,且C有最高正价+6,则C为S、E为O;D有-1价,原子半径小于O,故D为F;A有+2价,处于ⅡA族,原子半径大于硫元素,则A为Mg;B有+3价,处于ⅢA族,原子半径大于硫原子,故B为Al,据此解答.
解答 解:F原子中无中子,所以是H;G最高正价数与负价数相等,且最外层电子数是次外层的二倍,所以G是C元素;H元素单质焰色反应呈黄色,则H为Na;C、E都有-2价,且C有最高正价+6,则C为S、E为O;D有-1价,原子半径小于O,故D为F;A有+2价,处于ⅡA族,原子半径大于硫元素,则A为Mg;B有+3价,处于ⅢA族,原子半径大于硫原子,故B为Al.
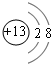
(1)B为Al,Al原子核外有3个电子层、最外层电子数为3,主族元素原子核外电子层数等于其周期数、最外层电子数等于其族序数,所以在周期表中位于第三周期第ⅢA族,Al3+离子的结构示意图为 ,
,
故答案为:第三周期第ⅢA族; ;
;
(2)同周期从左到右非金属性增强、同主族自上而下非金属性减弱,非金属性越强,最高价含氧酸的酸性越强,但是F没有正价,所以是H2SO4的酸性最强,故答案为:H2SO4;
(3)C、H形成化合物为Na2S,由钠离子与硫离子构成,用电子式表示形成过程为: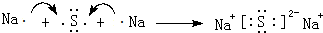 ,
,
故答案为: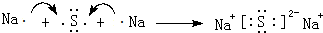 ;
;
(4)H、E形成原子个数比为1:1的化合物为Na2O2,过氧根中存在非极性共价键,钠离子和过氧根之间存在离子键,
故答案为:离子键和非极性键;
(5)G的最高价与E形成的化合物为CO2,电子式为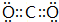 ,该分子的结构式为O=C=O,
,该分子的结构式为O=C=O,
故答案为: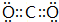 ;O=C=O;
;O=C=O;
(6)同周期自左而右原子半径减小、同主族自上而下原子半径增大,电子层数越多其半径越大,故原子半径:Mg>Al>S>O,
故答案为:Mg>Al>S>O.
点评 本题考查位置结构性质关系应用,推断元素是解题关键,侧重对化学用语的考查,理解掌握用电子式表示物质或化学键的形成.


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 完成下列小题
完成下列小题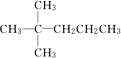 ,
,查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 生活中,用冰箱保存食物 | |
| B. | H2O2分解时,用MnO2 作催化剂 | |
| C. | 工业合成氨时,采用高温高压的措施 | |
| D. | 提高反应物的浓度 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
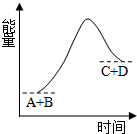
| A. | 形成C、D键释放的总能量大于断A、B键吸收的总能量 | |
| B. | 此反应反应物的总能量高于生成物的总能量 | |
| C. | 此反应为一个吸热的反应 | |
| D. | 此反应只有在加热条件下才能进行 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ba(OH)2•8H2O与NH4Cl反应 | B. | 铝与稀盐酸 | ||
| C. | 灼热的炭与CO2反应 | D. | 氢氧化钠溶液与醋酸溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
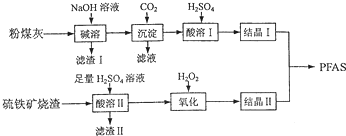
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com