
| A. | 按系统命名法,化合物  的名称为2-甲基-3,4-二乙基己烷 的名称为2-甲基-3,4-二乙基己烷 | |
| B. |  与 与 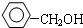 互为 同系物 互为 同系物 | |
| C. | 下列物质的沸点按由低到高顺序为:(CH3)2CHCH3<(CH3)4C<(CH3)2CHCH2CH3<CH3(CH2)3CH3 | |
| D. | 等质量的甲烷、乙醇、乙醛分别充分燃烧,所耗用氧气的量依次减小 |
分析 A、烷烃命名时,要选最长的碳链为主链,从离支链近的一端给主链上碳原子编号,据此分析;
B、当-OH直接连在苯环上时为酚;当-OH连在苯环的侧链上时为醇;
C、互为同系物的有机物,碳原子个数越多,熔沸点越高;互为同分异构体的有机物,支链越多,熔沸点越低;
D、CH4+2O2$\frac{\underline{\;点燃\;}}{\;}$CO2+2H2O、CH3CH2OH+3O2$\frac{\underline{\;点燃\;}}{\;}$2CO2+3H2O、
CH3CHO+$\frac{5}{2}$O2$\frac{\underline{\;点燃\;}}{\;}$2CO2+2H2O,假设甲烷、乙醇、乙醛的质量都是1g,则消耗氧气物质的量分别为$\frac{1}{16}$、$\frac{1}{46}$、$\frac{1}{44}$mol×$\frac{5}{2}$.
解答 解:A、该分子中最长的碳链含有6个C原子,含有两个支链,离甲基最近的碳原子为1号碳原子,乙基分别位于3、4号原子上,所以该物质名称是2-甲基-3,4-二乙基己烷,故A正确;
B、当-OH直接连在苯环上时为酚,故 为酚;当-OH连在苯环的侧链上时为醇,故
为酚;当-OH连在苯环的侧链上时为醇,故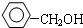 为醇,故两者的结构不相似,故不是同系物,故B错误;
为醇,故两者的结构不相似,故不是同系物,故B错误;
C、互为同系物的有机物,碳原子个数越多,熔沸点越高,故(CH3)4C、(CH3)2CHCH2CH3、CH3(CH2)3CH3的熔沸点均比(CH3)2CHCH3的高;互为同分异构体的有机物,支链越多,熔沸点越低,故(CH3)4C、(CH3)2CHCH2CH3、CH3(CH2)3CH3的熔沸点逐渐升高,故熔沸点为(CH3)2CHCH3<(CH3)4C<(CH3)2CHCH2CH3<CH3(CH2)3CH3,故C正确;
D、CH4+2O2$\frac{\underline{\;点燃\;}}{\;}$CO2+2H2O、CH3CH2OH+3O2$\frac{\underline{\;点燃\;}}{\;}$2CO2+3H2O、CH3CHO+$\frac{5}{2}$O2$\frac{\underline{\;点燃\;}}{\;}$2CO2+2H2O,假设甲烷、乙醇、乙醛的质量都是1g,则消耗氧气物质的量分别为$\frac{1}{16}$=0.125mol、$\frac{1}{46}$=0.0652mol、$\frac{1}{44}$mol×$\frac{5}{2}$=0.0568mol,所以消耗氧气物质的量逐渐减少,故D正确.
故选B.
点评 本题考查化学方程式计算、熔沸点比较、同系物概念、有机物命名等知识点,为高频考点,侧重考查基本概念及基本计算,注意:分子晶体熔沸点与分子间作用力和氢键有关,与化学键强弱无关,易错选项是B.


科目:高中化学 来源: 题型:选择题
| A. | Na+、Al3+、SO42-、HCO3- | B. | Cu2+、Mg2+、SO42-、NO3- | ||
| C. | Na+、K+、ClO-、SO42- | D. | Fe3+、K+、SO42-、I- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 滴定管的润洗是向滴定管中加入少量要盛装的溶液,边旋转边倾斜使溶液润湿全部内壁后从上口倒出 | |
| B. | 中和热的测定需要使用两个量筒分别量取酸碱溶液体积,使用两个温度计分别测定开始和终点的溶液温度 | |
| C. | 用密度为1.84g/cm3的浓硫酸配制100mL的2mol/L的稀硫酸,需要计算并称量浓硫酸的质量 | |
| D. | 用重结晶法提纯粗苯甲酸时,溶解度较小的杂质趁热过滤时留在了滤纸上,溶解度较大的杂质冷却结晶时留在了母液里 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯酚与溴水可以直接反应,而苯与液溴反应则需要铁作催化剂 | |
| B. | 乙烯能与溴水发生加成反应,而乙烷不能与溴水发生加成反应 | |
| C. | 甲苯能使酸性KMnO4溶液褪色,而甲基环己烷不能使酸性KMnO4溶液褪色 | |
| D. | 苯酚可以与NaOH反应,而乙醇不能与NaOH反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| t℃ | 700 | 800 | 950 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化合反应 | B. | 置换反应 | C. | 复分解反应 | D. | 氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2和SiO2化学键类型相同,晶体类型不同 | |
| B. | 碘晶体受热转变成碘蒸气,吸收的热量用于克服碘原子间的作用力 | |
| C. | 氯化氢溶于水能电离出H+、Cl-,所以氯化氢是离子化合物 | |
| D. | 氯化钠熔化时离子键未被破坏 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 非极性分子中不可能有极性键 | |
| B. | 中心原子sp3杂化且无孤电子对的粒子键角都是109°28 | |
| C. | 离子化合物中可能有非极性键 | |
| D. | 正四面体的结构键角都是109°28 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com