
研究碳、氮、硫的氧化物的性质对化工生产和环境保护有重要意义。
(1)下列措施中,有利于降低大气中的CO2、SO2、NO2浓度的有 (填字母);
a.减少化石燃料的使用,开发新能源
b.使用无氟冰箱,减少氟里昂排放
c.多步行或乘公交车,少用专车或私家车
d.将工业废气用碱液吸收后再排放
(2)为开发新能源,有关部门拟用甲醇(CH3OH)替代汽油作为公交车的燃料。写出由CO和H2生产甲醇的化学方程式 ,用该反应合成1mol液态甲醇吸收热量131.9kJ。又知![]()
![]() 。请写出液态甲醇燃烧生成二氧化碳和水蒸气的热化学方程式
。请写出液态甲醇燃烧生成二氧化碳和水蒸气的热化学方程式
;
|
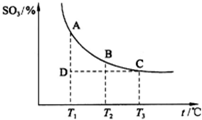
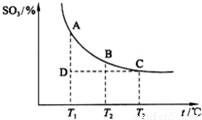
根据图示回答下列问题:
①![]()
![]() 2SO3(g)的
2SO3(g)的
△H 0(填“>”或“<”);
②若温度T1、T2时,反应的化学平衡常数分别
为K1、K2,则K1 K2;若反应进行到
状态D时, (填“>”、“<”或“=”)
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
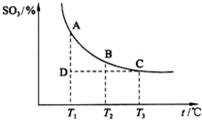 (2013?潍坊模拟)如图,研究碳、氮、硫的氧化物的性质对化工生产和环境保护有重要意义.
(2013?潍坊模拟)如图,研究碳、氮、硫的氧化物的性质对化工生产和环境保护有重要意义.| 3 |
| 2 |
| H | 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
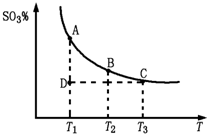 (2010?泰安二模)研究碳、氮、硫的氧化物的性质对化工生产和环境保护有重要意义.
(2010?泰安二模)研究碳、氮、硫的氧化物的性质对化工生产和环境保护有重要意义.| 3 | 2 |
查看答案和解析>>
科目:高中化学 来源:潍坊模拟 题型:问答题
| 3 |
| 2 |
| H | 2 |
查看答案和解析>>
科目:高中化学 来源:2013年山东省潍坊市高考化学仿真试卷(一)(解析版) 题型:解答题
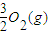 =
=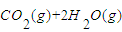
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com