
【题目】分类法是学习和研究化学物质的一种常用科学方法.下列“链状连环”图案中,相连的两种物质均可归属为一类,相交部分A、B、C、D为其分类依据代号.
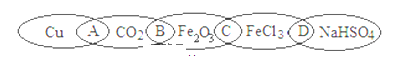
请回答:(1)请将A、B、C、D填入相应的横线内。
①两种物质都是盐_______;
②两种物质都不是电解质___________。
③写出鉴别CO2的离子反应方程式_______________。
④写出Fe2O3变成FeCl3的离子反应方程式_____________。
(2)用洁净的烧杯取25mL蒸馏水,加热至沸腾,逐滴加入上图中一种物质的饱和溶液5至6滴,继续加热,制得红褐色的胶体。
①、以上反应的化学方程式为____________。
②、向该胶体中逐滴加入稀硫酸,观察到:
A、先出现红褐色沉淀,说明胶体发生____;
B、随后红褐色沉淀溶解,反应的离子方程式是___________。
【答案】D A CO2 +Ca2+ + 2OH- =CaCO3 ↓+ H2O Fe2O3 + 6H+ = 2Fe3+ + 3H2O FeCl3+3H2O ![]() Fe(OH)3(胶体)+ 3HCl 聚沉 Fe(OH)3+3H+=Fe3+ +3H2O
Fe(OH)3(胶体)+ 3HCl 聚沉 Fe(OH)3+3H+=Fe3+ +3H2O
【解析】
(1)①硫酸氢钠和氯化铁是能电离出酸根阴离子和金属阳离子的化合物,属于盐类,故选D。
②铜属于单质,电解质必须是化合物,不属于电解质的范畴,二氧化碳的水溶液能导电,是生成的碳酸导电,二者不属于电解质,故选A。
③可将气体通入澄清石灰水中,澄清石灰水变浑浊说明气体中含有CO2,反应的离子方程式为CO2 +Ca2+ + 2OH- =CaCO3 ↓+ H2O。
④ Fe2O3与盐酸反应可生成FeCl3,反应的离子方程式为:Fe(OH)3+3H+=Fe3+ +3H2O
故答案为 D; A;CO2 +Ca2+ + 2OH- =CaCO3 ↓+ H2O;Fe2O3 + 6H+ = 2Fe3+ + 3H2O;
(2)①用洁净的烧杯取少量蒸馏水,用酒精灯加热至沸腾,向烧杯中逐滴加入氯化铁的饱和溶液,继续煮沸可制得一种红褐色氢氧化铁胶体,反应的化学方程式为 FeCl3+3H2O ===Fe(OH)3(胶体)+ 3HCl。
②胶体中加入电解质会发生聚沉,氢氧化铁可以和酸发生中和反应,氢氧化铁胶体中加入硫酸二者会先产生沉淀氢氧化铁,后沉淀溶解,发生反应的离子方程式为Fe(OH)3+3H+=Fe3+ +3H2O。
故答案为 FeCl3+3H2O![]() Fe(OH)3(胶体)+ 3HCl 聚沉 Fe(OH)3+3H+=Fe3+ +3H2O。
Fe(OH)3(胶体)+ 3HCl 聚沉 Fe(OH)3+3H+=Fe3+ +3H2O。


科目:高中化学 来源: 题型:
【题目】Ⅰ.碘酸钾(KIO3)是一种白色或无色固体,可溶于水,具有较强的氧化性。常添加于食盐中用以防治碘缺乏病。已知在某反应体系中存在以下几个物质: KIO3、K2SO4、KI、I2、H2SO4、H2O。
(1)写出上述反应的化学方程式_________。
(2)下列说法中正确的是_____。
A.I2是非电解质 B.K2SO4溶液的导电能力比KI溶液的强
C.H2SO4溶液在该反应中体现了酸性 D.KIO3既有氧化性又有还原性
Ⅱ.二氧化氯(ClO2)是高效安全的饮用水消毒剂,得到越来越广泛的应用,实验室可用KClO3通过以下反应制得:2KClO3+H2C2O4+H2SO4===2ClO2↑+K2SO4+2CO2↑+2H2O,试回答下列问题。
(3)该反应中还原产物的化学式是_____;被氧化的元素是______。
(4)用单线桥标出上述反应的电子转移情况____2KClO3+H2C2O4+H2SO4 == 2ClO2↑+K2SO4+2CO2↑+2H2O
(5)ClO2和Cl2均能将电镀废水中的CN 反应为无毒的物质,自身反应后均生成Cl,此过程说明ClO2和Cl2均具有__ (填“氧化”或“还原”)性。处理含相同量CN的电镀废水,所需Cl2的物质的量是ClO2的___倍。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无机物转化题。请根据下列物质之间的转化回答下列问题:
Na![]() Na2O2
Na2O2![]() NaOH
NaOH![]() Na2CO3
Na2CO3
(1)写出第①步反应的化学方程式并用双线桥法标出该反应的电子转移方向及数目________
(2)第②步反应的化学方程式_________,若将第②步反应所得产物称取40克,配制成1L的溶液,其物质的量浓度是________, 再将所配的溶液加水稀释到2L,其物质的量浓度是______________。
(3)第③步反应的离子方程式_______,上述①②③反应中属于氧化还原反应的是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.可以用丁达尔效应区分氯化铝溶液和氯化钠溶液
B.二氧化硅是一种酸性氧化物,故不能和酸发生反应
C.NaCl饱和溶液中依次通入足量的NH3、CO2,可析出NaHCO3
D.可以通过电解熔融氯化铝的方法来制备铝
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式不正确的是
A.Ba(OH)2溶液中滴加NaHSO4至完全沉淀:Ba2++OH-+H++SO42-=BaSO4↓+H2O
B.漂白粉的生产原理:2OH-+Cl2=Cl-+ClO-+H2O
C.二氧化硫通入溴水中,溴水褪色:SO2+Br2+2H2O=4H++2Br-+SO42-
D.AlCl3溶液加入过量的氨水:Al3++3NH3·H2O=Al(OH)3↓+3NH4+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用燃烧法测定某种氨基酸(CxHyOzNm)的分子组成。取Wg该种氨基酸放在纯氧中充分燃烧,生成二氧化碳、水和氮气。按下图所示装置进行实验。

回答下列问题:
(1)实验开始时,首先通入一段时间的氧气,其理由是__________________。
(2)以上装置中需要加热的仪器有_______ (填写字母),操作时应先点燃_____处的酒精灯。
(3)A装置中发生反应的化学方程式是____________________________。
(4)D装置的作用是____________________________。
(5)读取氮气的体积时,应注意①_________________;②_________________。
(6)实验中测得氮气的体积为VmL(标准状况),为确定此氨基酸的分子式,还需要的有关数据有____________________。
A.生成二氧化碳气体的质量
B.生成水的质量
C.通人氧气的体积
D.氨基酸的相对分子质量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为一“铁链”图案,图案上由左到右分别写了H2O、CO2、Na2O、NaCl、FeCl35种物质,图中相连的两种物质均可归属为一类,相交部分由左到右A、B、C、D为其相应的分类依据代号。请回答下列问题:

(1)请将分类依据代号填入相应的括号内:
(____)两种物质都是非金属氧化物
(____)两种物质都是钠的化合物
(____)两种物质中一种是酸性氧化物,一种是碱性氧化物
(____)两种物质都是盐
(2)用洁净的烧杯取少量蒸馏水,用酒精灯加热至沸腾,向烧杯中逐滴加入图中某种物质M的水溶液,继续煮沸可制得一种红褐色胶体。
①物质M的化学式为________。
②证明有红褐色胶体生成的最常用的实验操作是______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯乙烯是一种重要的化工原料,可采用乙苯催化脱氢法制备,反应如下:![]() (g)
(g)![]()
![]() (g)+H2(g) ΔH = +117.6kJ·mol-1
(g)+H2(g) ΔH = +117.6kJ·mol-1
(1)往刚性恒容容器中同时通入乙苯和水蒸气,测得容器总压和乙苯转化率随时间变化结果如图所示。
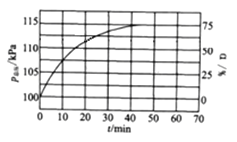
①平衡时,p(H2O)=_________,平衡常数Kp=_________kPa(Kp为以分压表示的平衡常数,请列式计算)
②下列说法正确的是_________
A.当混合气体的平均相对分子质量不再改变,反应达到平衡状态
B.增加通入水蒸气的量,有利于乙苯转化率的高
C.若将该反应置于恒压容器中反应,其他起始条件相同,乙苯的转化率将减小
D.仅往该刚性恒容容器中通入和上述等量的乙苯,其他条件相同,平衡时氢气的分压不变
(2)CO2气氛下乙苯催化脱氢可同时存在以下两种途径:

①请画出途径1的能量和反应过程的图像,并作适当标注______________

②途径I的反应历程如图所示,下列说法正确的是_________

A. CO2为氧化剂
B. 状态1到状态2形成了O-H键
C. 中间产物只有(![]() )
)
D. 该催化剂可提高乙苯的平衡转化率
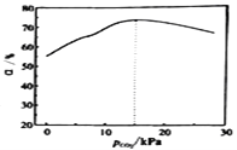
③刚性容器中,在催化剂作用下,一定时间内p(CO2)与乙苯转化率关系如图分析,则p(CO2)为15kPa时,乙苯转化率最高的可能原因_________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下①9.6gCH4 ②1molHCl分子 ③17.92 L H2S ④2.408×1023个NH3分子。则
A. 体积:②>③>④>① B. 密度:②>③>①>④
C. 质量:②>③>④>① D. H原子个数:①>③>④>②
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com