
| A、硫酸和食醋既是化合物又是酸 |
| B、含氧酸酸性越强与铁片反应放出氢气的速率越快 |
| C、含4%硅的硅钢具有很好的导磁性,主要用作变压器铁芯 |
| D、蛋白质、淀粉、纤维素、油脂等都能在人体内水解并提供能量 |


科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、焓变大于0的反应一定是自发进行的反应 |
| B、吸热反应一定是非自发进行的 |
| C、自发进行的反应一定容易发生 |
| D、有些吸热反应也能自发进行 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、HClO=ClO-+H+ |
| B、Cl-+H2O?HCl+OH- |
| C、CO32-+2H2O?H2CO3+2OH- |
| D、NH4++2H2O?NH3.H2O+H3O+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、饱和Ca(OH)2溶液中加入一定量的生石灰,恢复至原来的温度,得溶液的pH值会增大 |
| B、等体积、等pH的NH4Cl溶液和盐酸,完全溶解少量且等同的镁粉,前者反应快 |
| C、将nmol H2(g)、n mol I2(g)和2n mol H2(g)、2n mol I2(g)分别充入两个恒温恒容的容器中,平衡时H2的转化率前者小于后者 |
| D、某物质的溶液中由水电离出的c(H+)=1×10-amol.L-1,若α>7时,则该溶液的pH一定为14-α |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、AgNO3溶液中加入过量的氨水:Ag++NH3.H20═AgOH↓+NH+4 |
| B、向碳酸钡固体中加入足量NaHSO4溶液:BaCO3+SO42-═BaSO4+CO32- |
| C、溴化亚铁溶液中通入足量氯气:2Fe2++Cl2═3Fe3++2Cl- |
| D、澄清石灰水与少量小苏打溶液混合:Ca2++OH-+HCO3-=BaCO3↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,一定有Ba2+ |
| B、加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42- |
| C、加入硝酸银溶液有白色沉淀产生,一定有Cl- |
| D、加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝,一定有NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
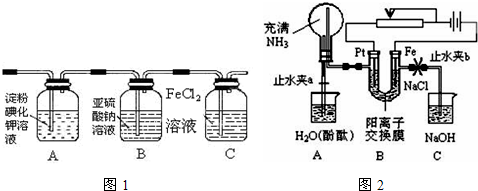
| 实验步骤 | 预期现象和结论 |
| 步骤1:取适量洗气瓶B中溶液于试管A中,滴加 | 若产生白色沉淀,则洗气瓶B溶液中存在SO42-. |
| 步骤2:另取适量洗气瓶B中溶液于试管B中,滴加 | 产生白色沉淀. |
| 步骤3:取步骤2后试管B中的上层清液于试管C中 滴加 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com