

| A、装置①常用于分离互不相溶的液体 |
| B、装置②可用于实验室加热酒精与浓硫酸的混合物制取乙烯 |
| C、装置③可用于制备乙酸乙酯 |
| D、装置④可用于收集NO、CO2等气体 |


科目:高中化学 来源: 题型:
 科学研究发现Cu2O可作为太阳光分解水的催化剂.
科学研究发现Cu2O可作为太阳光分解水的催化剂.
| ||
| 时间/min | 20 | 40 | 60 | 80 |
| n(O2)/mol | 0.0010 | 0.0016 | 0.0020 | 0.0020 |
查看答案和解析>>
科目:高中化学 来源: 题型:
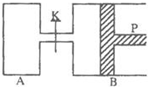 图中,P为一可自由滑动的活塞,关闭K,分别向容器A、B中各充入2mol X、2mol Y,起始时,VA=a L,VB=0.8a L(连通管的体积忽略不计),在相同温度和有催化剂存在的条件下,两容器中各自发生下述反应:3X(g)+3Y(g)?2Z(g)+2W(g),达到平衡时,VB=0.6a L.
图中,P为一可自由滑动的活塞,关闭K,分别向容器A、B中各充入2mol X、2mol Y,起始时,VA=a L,VB=0.8a L(连通管的体积忽略不计),在相同温度和有催化剂存在的条件下,两容器中各自发生下述反应:3X(g)+3Y(g)?2Z(g)+2W(g),达到平衡时,VB=0.6a L.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、分离FeCl3和AlCl3两种物质的混合物,只用氢氧化钠和二氧化碳即可 |
| B、用苯萃取溴水中的溴时,将溴的苯溶液从分液漏斗下口放出 |
| C、稀硫酸滴定未知浓度的NaHCO3溶液,用甲基橙作指示剂,溶液由黄色变为橙色 |
| D、在50mL量筒中配制0.1000mol?L-1碳酸钠溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
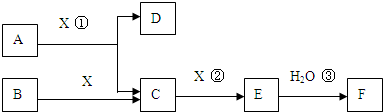
查看答案和解析>>
科目:高中化学 来源: 题型:
| [c(C)]c?[c(D)]d |
| [c(A)]a?[c(B)]b |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com