
【题目】在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力I随加入水的体积V变化的曲线如图所示。请回答:
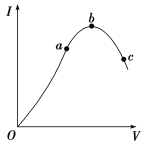
(1)“O”点导电能力为0的理由是_________________________。
(2)写出醋酸的电离方程式___________________________________________。
(3)a、b、c三点溶液中氢离子浓度由小到大的顺序为__________________ 。
(4)a、b、c三点处,电离程度最大的是________。
(5)醋酸与氨水反应的离子方程式:__________________ 。
(6)写出醋酸电离平衡常数表达式:_______________;
(7)向0.1mol/L 醋酸溶液中加入水,电离平衡向_______移动 (填“左”或“右”) ;n(CH3COOH)_______; c(CH3COO-)/c(CH3COOH)_______(填“增大”、“减小”或“不变”);
(8)500mL 0.1mol/L 醋酸溶液a和500mL 0.1mol/L 盐酸溶液b与足量Zn粉反应,初始速率a___b;生成H2的量a____b;完全中和这两种酸,消耗NaOH的量a___b(填“<”、“>”或“=”)。
【答案】纯醋酸未电离没有自由移动的离子,故不导电 CH3COOH![]() CH3COO-+H+ c<a<b c CH3COOH+NH3·H2O=CH3COO-+NH4++H2O K=
CH3COO-+H+ c<a<b c CH3COOH+NH3·H2O=CH3COO-+NH4++H2O K=![]() 右 减小 增大 < = =
右 减小 增大 < = =
【解析】
(1)溶液的导电性与离子浓度有关,离子浓度越大,导电性越强,冰醋酸中没有自由移动的离子,所以冰醋酸不导电,
故答案为:纯醋酸未电离没有自由移动的离子,故不导电;
(2)醋酸为弱电解质,其电离是不完全电离,其电离方程式为:CH3COOH![]() CH3COO-+H+;
CH3COO-+H+;
(3)导电能力越强,离子浓度越大,氢离子浓度越大,则a、b、c三点溶液的氢离子浓度关系为c<a<b;
(4)溶液越稀,越促进醋酸电离,则溶液稀释的倍数越大,电离程度越大,所以电离程度最大的是c,故答案为:c;
(5)醋酸为一元弱酸,氨水为一元弱碱,生成物水为弱电解质,离子方程式中均不拆分,生成的醋酸铵为盐,属于强电解质,需拆分,其反应的离子方程式为:CH3COOH+NH3·H2O=CH3COO-+NH4++H2O;
(6)根据电离平衡常数定义书写出其表达式为:K=![]() ;
;
(7)加水稀释,醋酸溶液浓度降低,根据越稀越电离,其电离平衡向右移动;平衡向右移动,导致n(CH3COOH)减小;![]() 等同于
等同于![]() ,根据上述分析,该比值增大;
,根据上述分析,该比值增大;
(8)500mL 0.1mol/L 醋酸溶液a和500mL 0.1mol/L 盐酸溶液中溶质的物质的量相等,且二者均为一元酸,故二者所含总氢离子数相等,因醋酸为弱酸,盐酸为强酸,故a溶液中c(H+)<b溶液中c(H+),故与足量Zn分反应,初始速率a<b;生成H2的量a=b;完全中和这两种酸,消耗NaOH的量a=b。


 字词句段篇系列答案
字词句段篇系列答案科目:高中化学 来源: 题型:
【题目】汉黄芩素是传统中草药黄芩的有效成分之一,对肿瘤细胞的杀伤有独特作用。下列有 关汉黄芩素的叙述正确的是
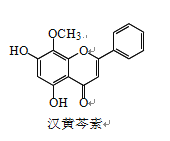
A. 汉黄芩素的分子式为 C16H13O5
B. 该物质遇 FeCl3 溶液显色
C. 1 mol 该物质与溴水反应,最多消耗 1 mol Br2
D. 与足量 H2 发生加成反应后,该分子中官能团的种类减少 1 种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有机化合物分子中所有的原子不可能都处于同一平面的是(
A.CF2=CF2B.HC≡CHC.C6H5—CH=CH—CHOD.CH3—O—CH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组以废催化剂(主要成分SiO2、ZnO、ZnS和CuS)为原料,制备锌和铜的硫酸盐晶体。设计的实验方案如下:
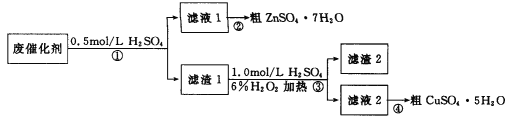
下列说法正确的是
A. 步骤①中能溶于稀硫酸的是ZnO、ZnS和CuS
B. 步骤①、③中发生的反应均为氧化还原反应
C. 步骤③涉及的离子反应可能为CuS+H2O2+2H+![]() Cu2++S+2H2O
Cu2++S+2H2O
D. 步骤②和④,采用蒸发结晶,过滤后均可获取粗晶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国科学院科研团队研究发现,在常温常压和可见光下,基于 LDH(一种固体催化剂)合成NH3的原理示意图如图所示。下列说法不正确的是( )
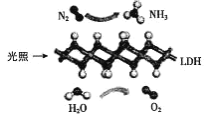
A.该反应属于置换反应
B.该过程中只涉及极性键的断裂与生成
C.基于 LDH 合成 NH3的过程属于氮的固定
D.该过程中每生成 2.24L(标准状况)O2则转移 0.4mol 电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外兴趣小组对H2O2的分解速率做了如下实验探究。
(1)下表是该小组研究影响过氧化氢(H2O2)分解速率的因素时采集的一组数据:
用10 mL H2O2制取150 mL O2所需的时间
浓度 时间(秒) 反应条件 | 30%H2O2 | 15%H2O2 | 10%H2O2 | 5%H2O2 |
(Ⅰ)无催化剂、不加热 | 几乎 不反应 | 几乎 不反应 | 几乎 不反应 | 几乎 不反应 |
(Ⅱ)无催化剂、加热 | 360 | 480 | 540 | 720 |
(Ⅲ)MnO2催化剂、加热 | 10 | 25 | 60 | 120 |
该小组在设计方案时,考虑了浓度、a:___________b:___________等因素对过氧化氢分解速率的影响。
②从上述影响H2O2分解速率的因素a和b中任选一个,说明该因素对该反应速率的影响:_____________。
(2)将质量相同但颗粒大小不同的MnO2分别加入到5 mL 5%的双氧水中,并用带火星的木条测试。测定结果如下:
催化剂 (MnO2) | 操作情况 | 观察结果 | 反应完成所需的时间 |
粉末状 | 混合不振荡 | 剧烈反应,带火星的木条复燃 | 3.5分钟 |
块状 | 反应较慢,火星红亮但木条未复燃 | 30分钟 |
①写出H2O2发生反应的化学方程式:______________________。
②实验结果说明催化剂作用的大小与________________有关。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于铝热反应2Al+Fe2O3![]() 2Fe+Al2O3的说法正确的是( )
2Fe+Al2O3的说法正确的是( )
A.Al发生氧化反应B.Fe2O3被氧化
C.Fe是还原剂D.Al2O3是氧化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2L的恒容容器中,充入1molA和3molB,并在一定条件下发生反应:A(g)+3B(g)![]() 2C(g);经3s后达到平衡,测得C气体的浓度为0.6 mol·L-1,下列说法中不正确的是( )
2C(g);经3s后达到平衡,测得C气体的浓度为0.6 mol·L-1,下列说法中不正确的是( )
A. 用B表示反应速率为0.3 mol·L-1·s-1
B. 平衡后,向容器中充入无关气体(如Ne),反应速率增大
C. 3s时生成C的物质的量为1.2mol
D. 平衡后,v(正)(A)=v(逆)(A)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A可由葡萄糖发酵得到,也可从酸牛奶中提取。纯净的A为无色黏稠液体,易溶于水。为研究A的组成与结构,进行了如下实验:
实验步骤 | 解释或实验结论 |
(1)称取9.0g A,升温使其汽化,测其密度是相同条件下氢气的45倍。 | (1)A的相对分子质量为:_____。 |
(2)将此9.0g A在足量纯氧气中充分燃烧,并使其产物依次缓缓通过浓硫酸、碱石灰,发现两者分别增重5.4g和13.2g。 | (2)A的分子式为:______。 |
(3)另取9.0g A,跟足量的碳酸氢钠粉末反应,生成2.24L CO2(标准状况),若与足量金属钠反应则生成2.24L氢气(标准状况)。 | (3)写出A中含有的官能团:____、_____。 |
(4)A的核磁共振氢谱如图:
| (4)A中含有______种氢原子。 |
(5)综上所述A的结构简式__________。 | |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com