
| A. | 若使电解质溶液恢复到电解前的浓度可向溶液中加入9.8×(10-b-10一a)g Cu(OH)2 | |
| B. | b<a<7 | |
| C. | 阳极产生的气体是O2,其体积(标准状况下)为:1.12×(10-b-10-a)L | |
| D. | 阴极电极反应式为:Cu2++2e-=Cu |
分析 根据题意分析,在聱个电解过程中始终只有一个电极上有气体产生,所以电解池工作时,阳极上氢氧根离子放电,生成氧气;阴极上铜离子得电子生成铜单质,所以电池反应式为2CuSO4+2H2O$\frac{\underline{\;电解\;}}{\;}$2H2SO4+2Cu+O2↑,电解后生成硫酸的物质的量=(10-b-10-a)mol/L×0.2L=0.2(10-b-10-a)mol.
解答 解:A、要使溶液恢复到原来的浓度,应向电解后的溶液中加入电解时析出的物质,即氧化铜,不是氢氧化铜,故A错误;
B、电解时,阳极上氢氧根离子放电,阴极上铜离子放电,所以导致溶液中氢离子浓度越来越大,溶液的PH值越来越小,即b<a<7,故B正确;
C、阳极上产生的气体是氧气,根据电池反应式计算氧气的体积.
设生成氧气的体积为V.
2CuSO4+2H2O$\frac{\underline{\;电解\;}}{\;}$2H2SO4+2Cu+O2↑,
2mol 22.4L
0.2(10-b-10-a)mol V
V=1.12(10-b-10-a)L,故C正确;
D、电解时,阴极上溶液中铜离子得电子发生还原反应,电极反应式为Cu2++2e-=Cu,故D正确.
故选A.
点评 本题以电解原理为载体考查了氧化还原反应的有关计算,难度较大,明确溶液中离子的放电顺序是解本题的关键.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:填空题
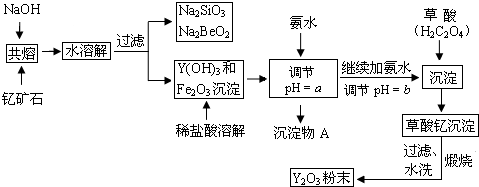
| 开始沉淀时的pH | 完全沉淀时的pH | |
| Fe3+ | 2.7 | 3.7 |
| Y3+ | 6.0 | 8.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 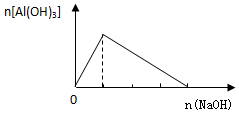 向AlCl3溶液中逐滴加入NaOH溶液 | |
| B. | 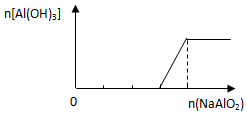 向稀盐酸中逐滴加入NaAlO2溶液 | |
| C. | 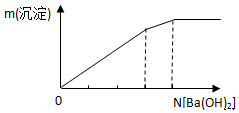 向明矾溶液中逐滴加入Ba(OH)2溶液 | |
| D. | 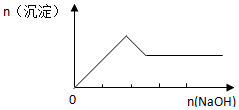 向Al2O3和Fe2O3的混合物中加入过量稀盐酸,向所得溶液中滴加NaOH的过程 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加 Ba(OH)2溶液,产生大量沉淀 | |
| B. | 加Ba(OH)2溶液,产生大量沉淀;再加盐酸,沉淀溶解,同时产生气体 | |
| C. | 加Ba(OH)2溶液,产生大量沉淀;再加盐酸,沉淀溶解,同时产生无色无味能使澄清石灰水变浑浊的气体 | |
| D. | 加BaCl2溶液,没有沉淀,再加NaOH溶液,产生大量沉淀;最后加盐酸,沉淀溶解,同时产生无色无味能使澄清石灰水变浑浊的气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 现有部分元素的存在,性质和原子结构如下所述:
现有部分元素的存在,性质和原子结构如下所述:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 糖类物质都有甜味,有甜味的物质都是糖类物质 | |
| B. | 蛋白质水解产物氨基酸可以合成人体所需蛋白质 | |
| C. | 蚕丝、羊毛和淀粉分别属于纤维素、蛋白质和多糖 | |
| D. | 食品包装袋、食物保鲜膜等材料的主要成份是聚氯乙烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
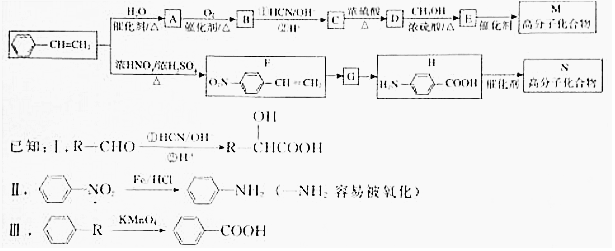
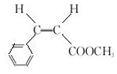 .
. 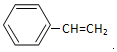 →F的反应类型为取代 反应.
→F的反应类型为取代 反应.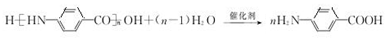 .
.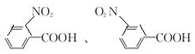 .
.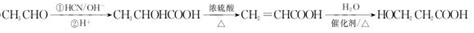 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
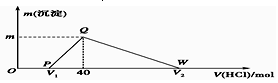
| A. | 原合金质量为0.92 g | |
| B. | 图中V2为60 | |
| C. | 整个滴定过程中Na+的浓度保持不变 | |
| D. | OP段发生的反应为:NaOH+HCl═NaCl+H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com