
(10分)已知A、B、C、D、E五种元素的原子序数依次增大,其中A原子所处的周期数、族序数都与其原子序数相等;B原子核外电子有6种不同的运动状态,s轨道电子数是p轨道电子数的两倍;D原子L电子层上有2对成对电子;E的+1价阳离子的核外有3层电子且各层均处于全满状态。
(1)E元素基态原子的核外电子排布式为___________________。
(2)B、C、D三种元素的第一电离能由小到大的顺序为_______(填元素符号)。其原因是 。
(3)B2A4是石油炼制的重要产物之一 。B2A4分子中B原子轨道的杂化类型为________;1 mol B2A2分子中含________mol σ键。
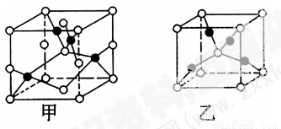
(4)已知D、E能形成晶胞结构如图所示的两种化合物,则化学式:甲为______,乙为______;高温时,甲易转化为乙的原因为______________________________。
(1)1s22s22p63s23p63d104s1或[Ar]3d104s1(1分)
(2)C<O<N(1分),同一周期从左向右,元素的第一电离能呈现逐渐增大的趋势,但氮元素的最外层电子达到半充满的稳定构型,故其第一电离能大于氧元素的(2分) (3)sp2(1分), 3(1分)
(4)CuO(1分) Cu2O(1分) Cu2O中Cu的各轨道均为全充满状态,较稳定(2分)
【解析】
试题分析:A、B、C、D、E五种元素的原子序数依次增大,A原子所处的周期数、族序数都与其原子序数相等,则A为H元素;B原子核外电子有6种不同的运动状态,S轨道电子数是P轨道电子数的两倍,则B原子核外有6个电子,则B为碳元素;D原子L层上有2对成对电子,则D原子电子排布式为1s22s22p4,所以D为氧元素;C的原子序数介于碳、氧元素之间,则C为氮元素;E+原子核外有3层电子且各层均处于全满状态,则E原子核外电子数为2+8+18+1=29,则E为Cu元素,则
(1)E为Cu元素,基态原子的核外电子排布式为:1s22s22p63s23p63d104s1;
(2)同周期,随原子序数增大元素第一电离能呈增大趋势,但氮元素2p能级为半满稳定状态,能量较低,失去第一个电子需要的能量较多,其第一电离能高于同周期相邻元素,故C、N、O三种元素的第一电离能数值由小到大的顺序为C<O<N;
(3)C2H4分子中C原子有3个σ键,无孤电子对,轨道的杂化类型为sp2杂化,1个C2H2分子中含有3个σ键,2个π键,则lmolC2H2分子中σ键3mol;
(4)已知O、Cu能形成晶胞如图所示的两种化合物,甲中黑色球数目=4,白色球数目=6×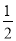 +8×
+8×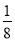 =4,Cu、O原子数目之比为1:1,则甲的化学式为CuO,乙中黑色球数目=4,白色球数目=1+8×
=4,Cu、O原子数目之比为1:1,则甲的化学式为CuO,乙中黑色球数目=4,白色球数目=1+8×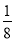 =2,黑色球与白色球个数之比为2:1,氧元素为-2价,则乙的化学式为Cu2O,Cu2O中Cu原子d轨道为全满状态,比较稳定,故高温时甲易转化为乙。
=2,黑色球与白色球个数之比为2:1,氧元素为-2价,则乙的化学式为Cu2O,Cu2O中Cu原子d轨道为全满状态,比较稳定,故高温时甲易转化为乙。
考点:考查物质结构与性质,涉及元素推断、核外电子排布、电离能、杂化轨道、化学键、晶胞计算等


科目:高中化学 来源:2013-2014安徽省、合肥六中第二学期期末联考高二化学试卷(解析版) 题型:填空题
(13分).巳知 A、B、D为中学常见的单质,甲、乙、丙、丁、戊为短周期元素组成的化合物。其中,丙是一种能使湿润的红色石蕊试纸变蓝的无色气体;丁是一种高能燃料,其组成元素与丙相同,1 mol 丁分子中不同原子的数目比为1 :2,且含有18 mol电子;戊是一种难溶于水的白色胶状物质,既能与强酸反应,也能与强碱反应,具有净水作用。各物质间的转化关系如下图所示(某些条件巳略去)。
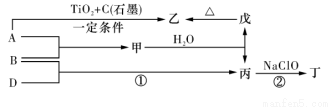
请回答:(1)单质B的组成元素在周期表中的位置是_________。
(2)戊的化学式为________。戊与强碱反应的离子方程式:________________
(3)丙中所包含的化学键类型有________ (填字母序号)。
a.离子键 b.极性共价键 c.非极性共价键
(4)反应①的化学方程式为________________________。
(5)反应②中,0.5mol NaClO参加反应时,转移1 mol电子,其化学方程式为_________
(6)—定条件下,A与TiO2、C(石墨)反应只生成乙和碳化钛(TiC),二者均为某些高温结构陶瓷的主要成分。巳知,该反应生成1 mol乙时放出536 kJ热量,其热化学方程式为_______________________
查看答案和解析>>
科目:高中化学 来源:2013-2014安徽省、合肥六中第二学期期末联考高一化学试卷(解析版) 题型:选择题
某化学反应反应物的总能量大于生成物的总能量,则该反应( )
A.是吸热反应 B.是放热反应
C.不一定遵循质量守恒定律 D.不需要加热就一定能发生
查看答案和解析>>
科目:高中化学 来源:2013-2014宁夏银川市高三第二次模拟考试理综化学试卷(解析版) 题型:填空题
【化学——选修2:化学与技术】(15分)
第五主族的磷单质及其化合物在工业上有广泛应用。
(1)同磷灰石在高温下制备黄磷的热化学方程式为:
4Ca5(PO4)3F(s)+21SiO2(s)+30C(s)=3P4(g)+20CaSiO3(s)+30CO(g)+SiF4(g) 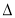 H
H
已知相同条件下:
4Ca3(PO4)2F(s)+3SiO2(s)=6Ca3(PO4)2(s)+2CaSiO3(s)+SiF4(g) △H1
2Ca3(PO4)2(s)+10C(s)=P4(g)+6CaO(s)+10CO(g) △H2
SiO2(s)+CaO(s)=CaSiO3(s) △H3
用△H1、△H2和△H3表示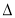 H,则
H,则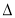 H= ;
H= ;
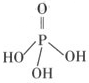
(2)三聚磷酸可视为三个磷酸分子(磷酸结构式如图)之间脱去两
个水分子产物,其结构式为 ,三聚
磷酸钠(俗称“五钠”)是常用的水处理剂,其化学式为 ;
(3)次磷酸钠(NaH2PO2)可用于工业上的化学镀镍。
①化学镀镍的溶液中含有Ni2+和H2PO2-,在酸性等条件下发生下述反应:
(a) Ni2+ + H2PO2-+ → Ni++ H2PO3-+
(b)6H2PO-2 +2H+ =2P+4H2PO3+3H2↑ 请在答题卡上写出并配平反应式(a);
请在答题卡上写出并配平反应式(a);
②利用①中反应可在塑料镀件表面沉积镍—磷合金,从而达到化学镀镍的目的,这是一种常见的化学镀。请从以下方面比较化学镀与电镀。
方法上的不同点: ;
原理上的不同点: ;
化学镀的优点: 。
查看答案和解析>>
科目:高中化学 来源:2013-2014宁夏银川市高三第二次模拟考试理综化学试卷(解析版) 题型:选择题
下列热化学方程式或离子方程式中,正确的是
A.0.01mol·L-1NH4Al(SO4)2溶液与0.02mol·L-1Ba(OH)2溶液等体积混合:
NH4++Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+Al(OH)3↓+NH3·H2O
B.一定条件下,将0.5mol N2(g)和1.5molH2(g)置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:
N2(g)+3H2(g) 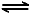 2NH3(g) △H=-38.6kJ·mol-1
2NH3(g) △H=-38.6kJ·mol-1
C.溴乙烷中滴入AgNO3溶液检验其中的溴元素:Br-+Ag+==AgBr↓
D.CO(g)的燃烧热是283.0 kJ·mol-1,则CO2分解的热化学方程式为:
2CO2(g) =2CO(g)+O2(g) ΔH=+283.0 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源:2013-2014宁夏高二下学期期末考试化学试卷(解析版) 题型:选择题
下列现象和应用与电子跃迁无关的是( )
A.激光 B.焰色反应 C.原子光谱 D.石墨导电
查看答案和解析>>
科目:高中化学 来源:2013-2014宁夏高二下学期期末考试化学试卷(解析版) 题型:选择题
下列各组顺序不正确的是( )
A.微粒半径大小:S2->Cl->F->Na+>Al3+
B.热稳定性大小:SiH4<PH3<NH3<H2O<HF
C.熔点高低:石墨>食盐>干冰>碘晶体
D.沸点高低:NH3>AsH3>PH3
查看答案和解析>>
科目:高中化学 来源:2013-2014宁夏高一下学期期中考试化学试卷(解析版) 题型:填空题
(8分)(1)将锌片和银片浸入稀硫酸中组成原电池,两电极间连接一个电流计。锌片上发生的电极反应: ;银片上发生的电极反应: 。
(2)若该电池中两电极的总质量为60g,工作一段时间后,取出锌片和银片洗净干燥后称重,总质量为47g,试计算:产生氢气的体积(标准状况)。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年陕西省五校高三第三联考理综化学试卷(解析版) 题型:选择题
利用实验仪器(规格和数量不限),能完成相应实验的一项是
选项 | 实验仪器(省略夹持装置) | 相应实验 |
A | 烧杯、玻璃棒、酒精灯 | CuSO4溶液的浓缩结晶 |
B | 蒸馏烧瓶、冷凝管、酒精灯 | 由工业酒精制无水酒精 |
C | 天平、玻璃棒、胶头滴管、容量瓶 | 配制NaCl0.5 mol.L-1的溶液100 mL |
D | 烧杯、玻璃棒、胶头滴管、分液漏斗 | 用溴水和CCl4,除去NaBr溶液中少量NaI |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com