
研究SO2、CO等大气污染气体的处理具有重要意义。
(1)利用钠碱循环法可脱除烟气中的SO2。在钠碱循环法中,用Na2SO3溶液作为吸收液吸收SO2的过程中,pH随n(SO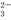 ):n(HSO
):n(HSO )变化关系如下表:
)变化关系如下表:
n(SO | 91∶9 | 1∶1 | 9∶91 |
pH | 8.2 | 7.2 | 6.2 |
①由上表判断,NaHSO3溶液显____________性,用平衡原理解释:_____________________;
②当吸收液呈中性时,溶液中离子浓度关系正确的是(选填字母)___________________;
a.c(Na+)=2c(SO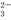 )+c(HSO
)+c(HSO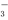 )
)
b.c(Na+)>c(HSO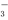 )>c(SO
)>c(SO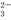 )>c(H+)=c(OH-)
)>c(H+)=c(OH-)
c.c(Na+)+c(H+)=c(SO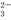 )+c(HSO
)+c(HSO )+c(OH-)
)+c(OH-)
(2)若某溶液中含3mol Na2SO3,滴入一定量的稀盐酸,恰好使溶液中Cl-和HSO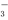 的物质的量之比为2:1,则滴入的盐酸中HCl的物质的量等于_____________mol;
的物质的量之比为2:1,则滴入的盐酸中HCl的物质的量等于_____________mol;
(3)CO可用于合成CH3OH,反应方程式为:CO(g)+2H2(g) CH3OH(g) ,在一定温度压强下,在容积为2L的密闭容器中通入0.2molCO与0.4molH2,达平衡时CO的转化率50%,则该温度下的平衡常数为 ,再加入1.0molCO后重新达到平衡,则CO的转化率 (填“增大”、“不变”或“减小”),CH3OH的体积分数 (填“增大”、“不变”或“减小”);
CH3OH(g) ,在一定温度压强下,在容积为2L的密闭容器中通入0.2molCO与0.4molH2,达平衡时CO的转化率50%,则该温度下的平衡常数为 ,再加入1.0molCO后重新达到平衡,则CO的转化率 (填“增大”、“不变”或“减小”),CH3OH的体积分数 (填“增大”、“不变”或“减小”);
(4)将0.02mol/LNa2SO4溶液与某浓度BaCl2溶液等体积混合,则生成BaSO4沉淀所需原BaCl2溶液的最小浓度为 。(已知Ksp(BaSO4)=1.1×10-10)
(5)甲醇对水质会造成一定的污染,有一种电化学法可消除这种污染,实验室用如图装置模拟上述过程,其原理是:通电后,将Co2+氧化成Co3+,然后以Co3+做氧化剂把水中的甲醇氧化成CO2而净化(Co3+的还原产物是Co2+)。
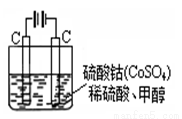
① 写出阳极电极反应式: ;
② 写出除去水中的甲醇的离子方程式: 。
 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案科目:高中化学 来源:2017届广东省高三10月月考化学卷(解析版) 题型:推断题
以A(C2H2)为原料合成食用香料E和吡咯(pyrrole)的路线如图所示,部分反应条件及产物略去。其中D在一定条件下可被氧化成酮。

回答下列问题:
(1)A的名称是 。
(2)已知C是反式产物,则C的结构简式为 ;⑥的反应类型是 。
(3)除羟基外,F还含有的官能团的名称是 。
(4)反应⑤的化学方程式为 。
(5)肉桂酸( )的同分异构体中,含有苯环和碳碳双键,且能够发生水解反应的共有 种 (不考虑顺反异构)。
)的同分异构体中,含有苯环和碳碳双键,且能够发生水解反应的共有 种 (不考虑顺反异构)。
(6)参照上述合成路线,设计一条由A和乙醛为起始原料制备2,5-二甲基吡咯( )的合成路线 。
)的合成路线 。
查看答案和解析>>
科目:高中化学 来源:2017届天津市高三上质量调查二化学卷(解析版) 题型:选择题
下列关于硅单质及其化合物的叙述正确的是( )
①硅是构成岩石和许多矿物的基本元素
②制造光导纤维的主要原料是Si
③水玻璃可用作制备木材防火剂的原料
④制玻璃和水泥均需要石灰石作为原料
⑤高纯度的硅除了用于制造计算机芯片外,在太阳能发电过程中也具有重要的作用.
⑥硅胶可用作催化剂的载体和袋装食品的抗氧化剂
A.①②③⑤ B.①③④⑤ C.①③⑥ D.全部
查看答案和解析>>
科目:高中化学 来源:2017届四川省泸州市高三上10月月考化学卷(解析版) 题型:填空题
(1)在一定条件下,将1.00molN2(g)与3.00molH2(g)混合于一个10.0L密闭容器中,在不同温度下达到平衡时NH3(g)的平衡浓度如图1所示。其中温度为T1时平衡混合气体中氨气的体积分数为25.0%。

当温度由T1变化到T2时,平衡常数关系K1 K2(填“>”,“<”或“=”)。
②该反应在T1温度下5.00min达到平衡,这段时间内N2的化学反应速率为 。
③T1温度下该反应的化学平衡常数K1= 。
(2)根据最新“人工固氮”的研究报道,在常温常压和光照条件下N2在催化剂表面与水发生反应:2N2(g)+6H2O(l)=4NH3(g)+3O2(g),此反应的△S 0(填“>”或“<”)。
若N2(g)+3H2(g)=2NH3(g) △H=a kJ/mol
2H2(g)+O2(g)=2H2O(l) △H=b kJ/mol
2N2(g)+6H2O(l)=4NH3(g)+3O2(g)的△H= (用含a、b的式子表示)。
(3)科学家采用质子高导电性的SCY陶瓷(可传递H+)实现了低温常压下高转化率的电化学合成氨,其实验原理示意图如图2所示,则阴极的电极反应式是 。
(4)已知某些弱电解质在水中的电离平衡常数(25℃)如下表:
弱电解质 | H2CO3 | NH3.H2O |
电离平衡常数 | Ka1=4.30×10-7 Ka2=5.61×10-11 | Kb=1.77×10-5 |
现有常温下0.1 mol·L-1的(NH4)2CO3溶液,
①该溶液呈 性(填“酸”、“中”、“碱”),原因是 。
②该(NH4)2CO3溶液中各微粒浓度之间的关系式不正确的是 。
A.c(NH4+)>c(CO32-)>c(HCO3-)>c(NH3.H2O)
B.c(NH4+)+c(H+)=c(HCO3-)+c(OH-)+c(CO32-)
C.c(CO32-)+c(HCO3-)+c(H2CO3)=0.1mol/L
D.c(NH4+)+c(NH3.H2O)=2c(CO32-)+2c(HCO3-)+2c(H2CO3)
E.c(H+)+c(HCO3-)+c(H2CO3)=c(OH-)+c(NH3.H2O)
查看答案和解析>>
科目:高中化学 来源:2017届四川省泸州市高三上10月月考化学卷(解析版) 题型:选择题
NA为阿伏加德罗常数的值。下列叙述正确的是( )
A.1.0L1.0mol·L-1的NaAlO2水溶液中含有氧原子数为2NA
B.16 g O3和O2混合物中氧原子数为NA
C.25℃时,pH=13的NaOH溶液中含有OH-的数目为0.1NA
D.1mol的羟基与1mol的氢氧根离子所含的电子数均为9NA
查看答案和解析>>
科目:高中化学 来源:2017届山西省大同市高三上学期第一次调研化学试卷(解析版) 题型:选择题
从下列事实所列出的相应结论正确的是 ( )
实 验 事 实 | 结 论 | |
① | Cl2的水溶液可以导电 | Cl2是电解质 |
② | 将燃烧的镁条放入CO2中能继续燃烧 | 还原性:Mg>C |
③ | NaHCO3溶液与NaAlO2溶液混合产生白色沉淀 | 酸性:HCO3->Al(OH)3 |
④ | 常温下白磷可自燃而氮气须在放电时才与氧气反应 | 非金属性:P>N |
⑤ | 某无色溶液中加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝 | 该溶液一定有NH4+ |
A.③④⑤ B.②③⑤ C.①②③ D.全部
查看答案和解析>>
科目:高中化学 来源:2017届山东省高三上学期10月质检化学试卷(解析版) 题型:实验题
Ⅰ、下列操作中,错误的是_ _
⑴用试管夹夹持试管时,试管夹从试管底部往上套,夹在试管的中上部
⑵给盛有液体的试管加热时,液体的体积不能超过容积的
⑶用酸式滴定管量取23.10mL溴水
⑷将试管平放,用纸槽往试管里送入固体粉末后,然后竖立试管
⑸提纯混有少量硝酸钾的氯化钠,应采用在较高温度下制得浓溶液再趁热过滤,干燥的方法
⑹取用放在细口瓶中的液体时,取下瓶塞倒放在桌面上,倾倒液体时,瓶上的标签对着手心
⑺用坩埚钳夹取加热后的蒸发皿
⑻将滴管垂直伸进试管内滴加液体
⑼稀释浓硫酸时,把水迅速倒入盛有浓硫酸的量筒中
⑽检验装置的气密性时,把导管的一端浸入水中,用手捂住容器的外壁或用酒精灯微热
⑾ 用10mL量筒量取5.2mL浓硫酸;
⑿用分液漏斗分离苯和四氯化碳的混合物;
Ⅱ、⑴高锰酸钾溶液常用于物质的定性检验与定量分析。
①实验室里欲用KMnO4固体来配制480 mL 0.1000 mol·L-1的KMnO4酸性溶液。
所用的仪器有天平、药匙、烧杯、玻璃棒、量筒、___ _、___ _。
②下列操作对实验结果的影响偏小的是__ __(填序号)。
a.加水定容时俯视刻度线
b.容量瓶内壁附有水珠而未干燥处理
c.颠倒摇匀后发现凹液面低于刻度线又加水补上
d.天平的砝码生锈
⑵、某化学兴趣小组,用新配制的酸性KMnO4溶液来测定某试剂厂生产的FeSO4溶液中Fe2+的物质的量浓度。
①写出酸性高锰酸钾与FeSO4溶液反应的离子方程式: 。
②该小组在测定过程中发现,测得的Fe2+的物质的量浓度比标签上的标注值要低,可能导致该测定结果的原因之一是FeSO4溶液变质; 证明方法 。
查看答案和解析>>
科目:高中化学 来源:2017届山东省高三上学期10月质检化学试卷(解析版) 题型:选择题
①用稀硝酸清洗做过银镜反应的试管
②用酒精清洗做过碘升华的烧杯
③用热的浓盐酸清洗残留二氧化锰的试管
④用盐酸清洗长期存放三氯化铁溶液的试剂瓶
⑤用热的氢氧化钠溶液清洗沾有硫磺的试管
下列对以上操作的判断正确的是 ( )
A. 全都正确 B. 除④外都对 C. 除⑤外都对 D. ④⑤不对
查看答案和解析>>
科目:高中化学 来源:2017届山东省临沂市高三上学期期中化学试卷(解析版) 题型:选择题
化学与社会、环境密切相关,下列有关说法错误的是
A.水玻璃可用于制备硅胶和木材防火剂
B.用浸泡过高锰酸钾溶液的硅藻土保鲜水果
C.煤的气化是物理变化,是 高效、清洁地利用煤的重要途径
高效、清洁地利用煤的重要途径
D.侯氏制碱法的工艺过程中应用了物质溶解度的差异
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com