
| 加热 |
| 加热 |
| 加热 |


科目:高中化学 来源: 题型:

| ||
| ||
| ||
| ||
查看答案和解析>>
科目:高中化学 来源:2013-2014学年湖北省高三上学期期末考试理综化学试卷(解析版) 题型:填空题
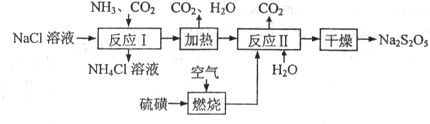
焦亚硫酸钠(Na2S2O5)常用作食品漂白剂。其制备工艺流程如下:
已知:反应Ⅱ包含2NaHSO3 Na2S2O5+H2O等多步反应。
Na2S2O5+H2O等多步反应。
(1)实验室制取氨气的化学方程式: 。
(2)“灼烧”时发生反应的化学方程式: 。
(3)已知Na2S2O5与稀硫酸反应放出SO2,其离子方程式为: 。
(4)副产品X的化学式是: ;可循环利用的物质是:_________和_______。
(5)为了减少产品Na2S2O5中杂质含量,需控制反应Ⅱ中气体与固体的物质的量之比约为 。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年江苏省高三上学期12月月考化学试卷(解析版) 题型:填空题
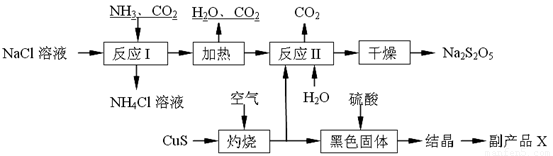
焦亚硫酸钠(Na2S2O5)常用作食品漂白剂。其制备工艺流程如下:

已知:反应Ⅱ包含2NaHSO3 Na2S2O5+H2O等多步反应。
Na2S2O5+H2O等多步反应。
(1)实验室制取氨气的化学方程式: 。
(2)反应I的化学方程式为: 。
(3)“灼烧”时发生反应的化学方程式: 。
(4)已知Na2S2O5与稀硫酸反应放出SO2,其离子方程式为: 。
(5)副产品X的化学式是 。
(6)为了减少产品Na2S2O5中杂质含量,需控制反应Ⅱ中气体与固体的物质的量之比约为 。检验产品中含有碳酸钠杂质所需试剂是 (填编号)
①酸性高锰酸钾 ②品红溶液 ③澄清石灰水
④饱和碳酸氢钠溶液 ⑤NaOH ⑥稀硫酸
查看答案和解析>>
科目:高中化学 来源:2013-2014学年广东省高三第三次月考理综化学试卷(解析版) 题型:填空题
焦亚硫酸钠(Na2S2O5)常用作食品漂白剂。其制备工艺流程如下:
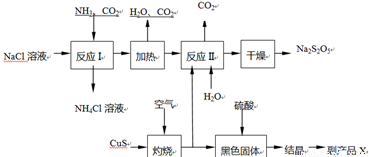
已知:反应Ⅱ包含2NaHSO3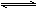 Na2S2O5+H2O等多步反应。
Na2S2O5+H2O等多步反应。
(1)实验室制取氨气的化学方程式: 。
(2)“灼烧”时发生反应的化学方程式: 。
(3)已知Na2S2O5与稀硫酸反应放出SO2,其离子方程式为: 。
(4)副产品X的化学式是: ;可循环利用的物质是:_____________。
(5)为了减少产品Na2S2O5中杂质含量,需控制反应Ⅱ中气体与固体的物质的量之比约
为 。
(6)检验产品中含有碳酸钠杂质所需试剂是 (填编号)
①酸性高锰酸钾 ②品红溶液 ③澄清石灰水 ④饱和碳酸氢钠溶液 ⑤NaOH ⑥稀硫酸
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com