
½«”°·ĻŌÓĶŃĢ³¾”±ÓĆĮņĖįĪüŹÕ½žČ”£¬¼Čæɱ£»¤»·¾³ÓÖæɵƵ½ÓĆĶ¾¹ć·ŗµÄøß“æĮņĖįŠæ”£ŅŃÖŖŃĢ³¾ÖŠÖ÷ŅŖŗ¬ZnO£¬»¹ÓŠÉŁĮæµÄFeO”¢Fe2O3”¢CuO”¢MnO”£Öʱø¹¤ŅÕĮ÷³ĢČēĻĀ£ŗ
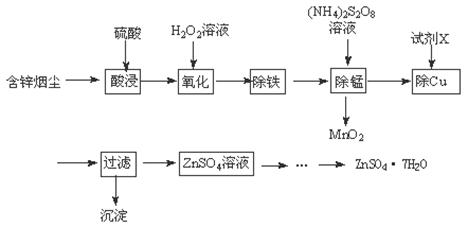
£Ø1£©ĮņĖįŠæČÜŅŗµĪČėŹÆČļŹŌŅŗ£¬ČÜŅŗ±äŗģ£¬ĘäŌŅņŹĒ ”£
£Ø2£©H2O2Ńõ»ÆFe2+µÄĄė×Ó·½³ĢŹ½ĪŖ ”£
£Ø3£©”°³żĢś”±Ź±£¬ČÜŅŗµÄpHÓ¦µ÷Õūµ½ £ØĻą¹Ų½šŹōĄė×ÓÉś³ÉĒāŃõ»ÆĪļ³ĮµķµÄpH¼°³ĮµķĶźČ«µÄpHČēĻĀ±ķ£¬½šŹōĄė×ÓæŖŹ¼³ĮµķŹ±µÄÅضČĪŖ1mol”¤L£1£©”£
| ½šŹōĄė×Ó | æŖŹ¼³ĮµķµÄpH | ³ĮµķĶźČ«µÄpH |
| Fe3+ | 1.1 | 3.2 |
| Zn2+ | 5.5 | 8.0 |
| Cu2+ | 5.2 | 6.7 |
| Fe2+ | 5.8 | 8.8 |
£Ø4£©”°³żĆĢ”±Ź±ČÜŅŗÖŠ·¢Éś·“Ó¦µÄ»Æѧ·½³ĢŹ½ĪŖ ”£
£Ø5£©ŹŌ¼ĮXĪŖ ”£
£Ø6£©ÓÉZnSO4ČÜŅŗŠč¾¹ż£ŗ ”¢ ”¢¹żĀĖ¼°øÉŌļµĆZnSO4”¤7H2O”£

| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ£Ø””””£©
| ”” | A£® | ĪļÖŹµÄ»Æѧ±ä»Æ¶¼°éĖę×ÅÄÜĮæ±ä»Æ |
| ”” | B£® | ·²ŹĒĪüČČ·“Ó¦¶¼ŠčŅŖ¼ÓČČ |
| ”” | C£® | ±ķŹ¾ÖŠŗĶČȵÄČČ»Æѧ·½³ĢŹ½£ŗNaOH+HClØTNaCl+H2O ”÷H=©57.3 kJ•mol©1 |
| ”” | D£® | µČÖŹĮæµÄĮņÕōĘųŗĶĮņ¹ĢĢå·Ö±šĶźČ«Č¼ÉÕ£¬ŗóÕ߷ųöČČĮæøü¶ą |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
ĄąĶĘĖ¼Ī¬ŹĒ»Æѧ½ā ĢāÖŠ³£ÓƵÄŅ»ÖÖĖ¼Ī¬·½·Ø£¬ĻĀĮŠÓŠ¹ŲĄė×Ó·½³ĢŹ½µÄĄąĶĘÕżČ·µÄŹĒ( )
ĢāÖŠ³£ÓƵÄŅ»ÖÖĖ¼Ī¬·½·Ø£¬ĻĀĮŠÓŠ¹ŲĄė×Ó·½³ĢŹ½µÄĄąĶĘÕżČ·µÄŹĒ( )
| ŅŃÖŖ | ĄąĶĘ | |
| A | ½«Fe¼ÓČėCuSO4ČÜŅŗÖŠ Fe+Cu2+=Cu+Fe2+ | ½«Na¼ÓČėµ½CuSO4ČÜŅŗÖŠ 2Na+Cu2+=Cu+2Na+ |
| B | ĻņĻ”ĮņĖį¼ÓČėNaOHČÜŅŗÖĮÖŠŠŌ H++OH-=H2O | ĻņH2SO4ČÜŅŗ¼ÓČėBa(OH)2ČÜŅŗÖĮÖŠŠŌ H++OH-=H2O |
| C | ĻņĀČ»ÆĀĮČÜŅŗÖŠ¼ÓČė×ćĮæNaOHČÜŅŗ Al3+ + 4OH- = AlO2- + 2H2O | ĻņĀČ»ÆĀĮČÜŅŗÖŠ¼ÓČė×ćĮæ°±Ė® Al3+ + 4NH3”¤H2O = AlO2- + 2H2O +4NH4+ |
| D | ĻņCa(OH)2ČÜŅŗÖŠĶØČė¹żĮæ CO2 | ĻņCa(OH)2ČÜŅŗÖŠĶØČė¹żĮæSO2 SO2 + OH- = HSO3- |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
ÉčNA ±ķŹ¾°¢·ü¼ÓµĀĀŽ³£ŹżµÄÖµ”£ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ
A£®±ź×¼×“æöĻĀ£¬22.4LCH2Cl2ÖŠŗ¬C£Cl¼üŹżÄæĪŖ0.2NA
B£®³£ĪĀ³£Ń¹ĻĀ£¬10g92%¾Ę¾«Ė®ČÜŅŗŗ¬ŃõŌ×Ó×ÜŹżĪŖ0.2NA
C£®³£ĪĀ³£Ń¹ĻĀ£¬0.1molNa2O2ÓėĖ®ĶźČ«·“Ó¦×ŖŅʵē×ÓŹżĪŖ0.2NA
D£®³£ĪĀ³£Ń¹ĻĀ£¬3.0gÄņĖŲÓėŅŅĖįµÄ»ģŗĻĪļ£¬ŗ¬ĒāŌ×Ó×ÜŹżĪŖ0.2NA
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
ŅŃÖŖ25”ꏱ£¬H2SµÄµēĄė³£ŹżKa1”¢Ka2Āś×ć Ka1”¤Ka2=3”Į10£22£¬H2S±„ŗĶČÜŅŗĪļÖŹµÄĮæÅضČŌ¼ĪŖ0.10mol”¤L£1£»Ksp(CuS)=6”Į10£36£¬Ksp(MnS)=4.5”Į10£14”£ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ
A£®ĻąĶ¬ĪĀ¶ČĻĀ£¬CuSŌŚĖ®ÖŠµÄČܽā¶Č±ČMnSŠ”
B£®CuSŗĶMnSŅ»¶Ø¶¼ČÜÓŚĒæĖį
C£®·“Ó¦£ŗCu2+(aq)+MnS(s)=CuS(s)+Mn2+ K=7.5”Į1021
D£®ŌŚÅØ¶Č¾łĪŖ0.01mol”¤L£1Cu2+ŗĶMn2+»ģŗĻČÜŅŗÖŠ£¬ĶØČėH2SÖ»ÓŠMnS³Įµķ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
ŌĖÓĆ»Æѧ·“Ó¦ŌĄķŃŠ¾æŌŖĖŲ¼°Ęä»ÆŗĻĪļµÄ·“Ó¦ÓŠÖŲŅŖŅāŅ唣
£Ø1£©ĮņĖįÉś²śÖŠ£¬SO2“ß»ÆŃõ»ÆÉś³ÉSO3£ŗ2SO2(g)£« O2(g) 2SO3(g)£¬»ģŗĻĢåĻµÖŠSO3µÄ°Ł·Öŗ¬ĮæŗĶĪĀ¶ČµÄ¹ŲĻµČēÓŅĶ¼ĖłŹ¾£ØĒśĻßÉĻČĪŗĪŅ»µć¶¼±ķŹ¾Ę½ŗāדĢ¬£©”£øł¾ŻĶ¼Ź¾»Ų“šĻĀĮŠĪŹĢā£ŗ
2SO3(g)£¬»ģŗĻĢåĻµÖŠSO3µÄ°Ł·Öŗ¬ĮæŗĶĪĀ¶ČµÄ¹ŲĻµČēÓŅĶ¼ĖłŹ¾£ØĒśĻßÉĻČĪŗĪŅ»µć¶¼±ķŹ¾Ę½ŗāדĢ¬£©”£øł¾ŻĶ¼Ź¾»Ų“šĻĀĮŠĪŹĢā£ŗ

¢Ł2SO2(g) + O2(g) 2SO3(g)µÄ”÷H____0(Ģī”°>”±”¢”°<”±)”£ČōŌŚŗćĪĀ”¢ŗćŃ¹Ģõ¼žĻĀĻņÉĻŹöĘ½ŗāĢåĻµÖŠĶØČėŗ¤Ęų£¬Ę½ŗā ŅĘ¶Æ£ØĢī”°Ļņ×ó”±”°ĻņÓŅ”±»ņ”°²»ŅĘ¶Æ”±£© ”£
2SO3(g)µÄ”÷H____0(Ģī”°>”±”¢”°<”±)”£ČōŌŚŗćĪĀ”¢ŗćŃ¹Ģõ¼žĻĀĻņÉĻŹöĘ½ŗāĢåĻµÖŠĶØČėŗ¤Ęų£¬Ę½ŗā ŅĘ¶Æ£ØĢī”°Ļņ×ó”±”°ĻņÓŅ”±»ņ”°²»ŅĘ¶Æ”±£© ”£
¢ŚČōĪĀ¶ČĪŖT1Ź±£¬·“Ó¦½ųŠŠµ½×“Ģ¬DŹ±£¬VÕż_______VÄę£ØĢī”°>”±”°<”±»ņ”°=”±£©
£Ø2£©µŖŹĒµŲĒņÉĻŗ¬Įæ·įø»µÄŅ»ÖÖŌŖĖŲ£¬µŖ¼°Ęä»ÆŗĻĪļŌŚ¹¤Å©ŅµÉś²śÖŠÓŠÖŲŅŖ×÷ÓĆ”£
¢Ł ÓŅĶ¼ŹĒŅ»¶ØµÄĪĀ¶ČŗĶŃ¹ĒæĻĀN2ŗĶH2·“Ӧɜ³ÉlmolNH3¹ż³ĢÖŠÄÜĮæ±ä»ÆŹ¾ŅāĶ¼£¬ĒėŠ“³ö¹¤ŅµŗĻ³É°±µÄČČ»Æѧ·½³ĢŹ½£ŗ£Ø”÷HÓĆŗ¬×ÖÄøQ1”¢Q2µÄ“śŹżŹ½±ķŹ¾£© ”£
¢ŚŌŚAlCl3ČÜŅŗÖŠµĪ¼Ó°±Ė®£¬·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖ£ŗ ”£
£Ø3£©ŗ£Ė®ÖŠŗ¬ÓŠ“óĮæµÄŌŖĖŲ£¬³£ĮæŌŖĖŲČēĀČ”¢Ī¢ĮæŌŖĖŲČēµāŌŚŗ£Ė®ÖŠ¾łŅŌ»ÆŗĻĢ¬“ęŌŚ”£ŌŚ25”ęĻĀ£¬Ļņ0.1mol•L£1µÄNaClČÜŅŗÖŠÖšµĪ¼ÓČėŹŹĮæµÄ0.1mol•L£1ĻõĖįŅųČÜŅŗ£¬ÓŠ°×É«³ĮµķÉś³É£¬Ļņ·“Ó¦ŗóµÄ×ĒŅŗÖŠ£¬¼ĢŠų¼ÓČė0.1mol•L£1µÄNaIČÜŅŗ£¬æ“µ½µÄĻÖĻóŹĒ Č«Ę·½ĢѧĶų£¬ ÓĆŗóĄė²»ĮĖ£”£¬²śÉśøĆĻÖĻóµÄŌŅņŹĒ£ØÓĆĄė×Ó·½³ĢŹ½±ķŹ¾£©£ŗ ”£
Č«Ę·½ĢѧĶų£¬ ÓĆŗóĄė²»ĮĖ£”£ØŅŃÖŖ25”ꏱKsp[AgCl] =1.0”Į10-10 mol2•L£2£¬Ksp[AgI] =1.5”Į10-16mol2•L£2 £©
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
CO2ŗĶCH4ŹĒĮ½ÖÖÖŲŅŖµÄĪĀŹŅĘųĢ壬ĶعżCH4ŗĶCO2·“Ó¦ÖĘŌģøüøß¼ŪÖµ»ÆѧʷŹĒÄæĒ°µÄŃŠ¾æÄæ±ź”£
£Ø1£©250”ꏱ£¬ŅŌÄųŗĻ½šĪŖ“߻ƼĮ£¬Ļņ4 LČŻĘ÷ÖŠĶØČė6 mol CO2”¢6 mol CH4£¬·¢ÉśČēĻĀ·“Ó¦£ŗCO2 (g)£«CH4(g) 2CO(g)£«2H2(g)”£Ę½ŗāĢåĻµÖŠø÷×é·ÖĢå»ż·ÖŹżČēĻĀ±ķ£ŗ
2CO(g)£«2H2(g)”£Ę½ŗāĢåĻµÖŠø÷×é·ÖĢå»ż·ÖŹżČēĻĀ±ķ£ŗ
| ĪļÖŹ | CH4 | CO2 | CO | H2 |
| Ģå»ż·ÖŹż | 0.1 | 0.1 | 0.4 | 0.4 |
¢Ł“ĖĪĀ¶ČĻĀøĆ·“Ó¦µÄĘ½ŗā³£ŹżK=__________
¢ŚŅŃÖŖ£ŗCH4(g)£«2O2(g)£½CO2(g)£«2H2O(g) ”÷H=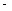 890.3 kJ·mol£1
890.3 kJ·mol£1
CO(g)£«H2O (g)£½CO2(g)£«H2 (g) ”÷H=+2.8 kJ·mol£1
2CO(g)£«O2(g)£½2CO2(g) ”÷H=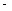 566.0 kJ·mol£1
566.0 kJ·mol£1
·“Ó¦CO2(g)£«CH4(g) 2CO(g)£«2H2(g) µÄ”÷H=________________
2CO(g)£«2H2(g) µÄ”÷H=________________
£Ø2£©ŅŌ¶žŃõ»ÆīѱķĆęø²øĒCu2Al2O4ĪŖ“߻ƼĮ£¬æÉŅŌ½«CO2ŗĶCH4Ö±½Ó×Ŗ»Æ³ÉŅŅĖį”£
¢ŁŌŚ²»Ķ¬ĪĀ¶ČĻĀ“߻ƼĮµÄ“߻Ɗ§ĀŹÓėŅŅĖįµÄÉś³ÉĖŁĀŹČēÓŅĶ¼ĖłŹ¾”£250”«300”ꏱ£¬ĪĀ¶ČÉżø߶ųŅŅĖįµÄÉś³ÉĖŁĀŹ½µµĶµÄŌŅņŹĒ_____________________

¢ŚĪŖĮĖĢįøßøĆ·“Ó¦ÖŠCH4µÄ×Ŗ»ÆĀŹ£¬æÉŅŌ²ÉČ”µÄ“ėŹ©ŹĒ________________________
¢Ū½«Cu2Al2O4ČܽāŌŚĻ”ĻõĖįÖŠµÄĄė×Ó·½³ĢŹ½ĪŖ___________________________
£Ø3£©Li2O”¢Na2O”¢MgO¾łÄÜĪüŹÕCO2”£¢ŁČē¹ūŃ°ÕŅĪüŹÕCO2µÄĘäĖūĪļÖŹ£¬ĻĀĮŠ½ØŅéŗĻĄķµÄŹĒ______
a.æÉŌŚ¼īŠŌŃõ»ÆĪļÖŠŃ°ÕŅ
b.æÉŌŚ¢ńA”¢¢ņA×åŌŖĖŲŠĪ³ÉµÄŃõ»ÆĪļÖŠŃ°ÕŅ
c.æÉŌŚ¾ßÓŠĒæŃõ»ÆŠŌµÄĪļÖŹÖŠŃ°ÕŅ
¢ŚLi2OĪüŹÕCO2ŗ󣬲śĪļÓĆÓŚŗĻ³ÉLi4SiO4£¬Li4SiO4ÓĆÓŚĪüŹÕ”¢ŹĶ·ÅCO2”£ŌĄķŹĒ£ŗŌŚ500”ę£¬CO2ÓėLi4SiO4½Ó“„ŗóÉś³ÉLi2CO3£»Ę½ŗāŗó¼ÓČČÖĮ700”ę£¬·“Ó¦ÄęĻņ½ųŠŠ£¬·Å³öCO2£¬Li4SiO4ŌŁÉś£¬ĖµĆ÷øĆŌĄķµÄ»Æѧ·½³ĢŹ½ŹĒ___________________________
£Ø4£©ĄūÓĆ·“Ó¦Aæɽ«ŹĶ·ÅµÄCO2×Ŗ»ÆĪŖ¾ßÓŠ¹¤ŅµĄūÓĆ¼ŪÖµµÄ²śĘ·”£
·“Ó¦A£ŗ
øßĪĀµē½ā¼¼ŹõÄÜøߊ§ŹµĻÖ£Ø3£©ÖŠ·“Ó¦A£¬¹¤×÷ŌĄķŹ¾ŅāĶ¼ČēĻĀ£ŗ
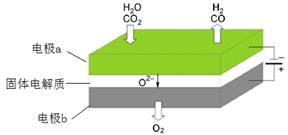
CO2ŌŚµē¼«a·ÅµēµÄ·“Ó¦Ź½ŹĒ_____________________________________________
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
ŗĻ³É°±¹¤Ņµ¶Ō»ÆѧŗĶ¹ś·Ą¹¤Ņµ¾ßÓŠÖŲŅŖŅāŅ唣
(1)ŹµŃéŹŅÓūÓĆČēĶ¼ĖłŹ¾×°ÖĆ(¼Š³Ö¹Ģ¶Ø×°ÖĆĀŌČ„)Öʱø²¢ŹÕ¼Æ°±Ęų”£
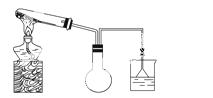
¢ŁĒėŌŚĶ¼ÖŠÉÕĘæÄŚ»ę³öµ¼ ¹ÜĖłČ±²æ·Ö”£
¹ÜĖłČ±²æ·Ö”£
¢ŚŹŌ¹ÜÖŠ·¢Éś·“Ó¦µÄ»Æѧ·½³ĢŹ½ŹĒ____________”£
¢ŪĪŖĪüŹÕ¶ąÓąµÄ°±Ęų£¬ÉÕ±ÖŠµÄŹŌ¼ĮŹĒ________”£
(2)°±ÓŠŗܶąÖŲŅŖŠŌÖŹ”£
¢Ł½«·ÓĢŖČÜŅŗµĪ¼Óµ½°±Ė®ÖŠČÜŅŗ³ŹŗģÉ«£¬ĘäŌŅņŹĒ_________
_____________________________________________________ӣ
¢Ś¹ÜµĄ¹¤ČĖŌų¾ÓĆÅØ°±Ė®¼ģŃéĀČĘų¹ÜµĄŹĒ·ńŠ¹Ā©£¬Čē³öĻÖ°×ŃĢ£¬ĖµĆ÷ÓŠĀČĘųŠ¹Ā©£¬Ķ¬Ź±»¹ÓŠŅ»ÖÖĻą¶Ō·Ö×ÓÖŹĮæĪŖ28µÄĘųĢåÉś³É£¬øĆ·“Ó¦µÄ»Æѧ·½³ĢŹ½ŹĒ________”£
(3)Š“³ö°±µÄĮ½ÖÖÓĆĶ¾£ŗ______________________”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
ĪļÖŹµÄĮæÖ®±ČĪŖ1”Ć3µÄŠæÓėĻ”ĻõĖį·“Ó¦£¬ČōĻõĖį±»»¹ŌµÄ²śĪļĪŖN2O£¬·“Ó¦½įŹųŗóŠæƻӊŹ£Óą£¬ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ(””””)”£
A£®ŌŚ“Ė·“Ó¦ÖŠĻõĖįĢåĻÖĒæŃõ»ÆŠŌ£¬Č«²æ±»»¹Ō
B£®Ļņ·“Ó¦ŗóµÄČÜŅŗÖŠŌŁ¼ÓČė½šŹōĢś£¬²»ŌŁ·¢Éś»Æѧ·“Ó¦
C£®øĆ·“Ó¦ÖŠ±»»¹ŌµÄĻõĖįÓėĪ“±»»¹ŌµÄĻõĖįÖ®±ČĪŖ1”Ć4
D£®øĆ·“Ó¦ÖŠ±»»¹ŌµÄĻõĖįÓėĪ“±»»¹ŌµÄĻõĖįÖ®±ČĪŖ1”Ć5
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com