
| A. | 3:2:1:4 | B. | 1:1:1:1 | C. | 1:2:1:2 | D. | 2:2:1:1 |
分析 加热高锰酸钾的方程式为2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑,转移电子是4mol,氯酸钾分解反应的方程式为2KClO3$\frac{\underline{\;MnO_2\;}}{\;}$2KCl+3O2↑,转移电子是12mol,2H2O2$\frac{\underline{\;催化剂\;}}{\;}$2H2O+O2↑,转移电子是2mol,2Na2O2+2H2O═4NaOH+O2↑中转移电子是2mol,根据转移电子的数目和获得氧气的量进行计算.
解答 解:加热高锰酸钾的方程式为2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑,转移电子是4mol,氯酸钾分解反应的方程式为2KClO3$\frac{\underline{\;MnO_2\;}}{\;}$2KCl+3O2↑,转移电子是12mol,2H2O2$\frac{\underline{\;催化剂\;}}{\;}$2H2O+O2↑,转移电子是2mol,2Na2O2+2H2O═4NaOH+O2↑转移电子是2mol,当获得氧气的质量均是32g,即1mol时,转移电子数分别是4mol、4mol、2mol、2mol,所以所转移的电子数目之比是2:2:1:1.
故选D.
点评 本题考查学生氧化还原反应中电子转移情况,注意化合价升高数=化合价降低数值=转移电子数这一规律的应用,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | KCl固体 | B. | Zn粉 | C. | SO3固体 | D. | CuSO4晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氨气在一定条件下能和氧气反应 | |
| B. | 氨是一种易溶、易液化的气体 | |
| C. | 氨气能用浓硫酸来干燥 | |
| D. | 氨的水溶液能使红色石蕊试液变蓝色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
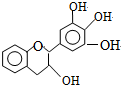 没食子儿茶素的结构如图所示,关于该物质下列叙述中正确的是( )
没食子儿茶素的结构如图所示,关于该物质下列叙述中正确的是( )| A. | 分子式为C15H12O5 | |
| B. | 遇FeCl3溶液不发生显色反应 | |
| C. | 1mol该物质与4molNaOH恰好完全反应 | |
| D. | 易发生氧化反应和取代反应,难发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题

| A. | 用甲图装置灼烧海带成海带灰 | |
| B. | 用乙图装置实验室制氨气 | |
| C. | 用丙图装置可制得金属锰 | |
| D. | 用丁图装置验证NaHCO3和Na2CO3的稳定性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若溶质为NaA,溶液中可能存在:c (OH-)=c(H+)+c(HA) | |
| B. | 若c(OH-)>c(H+),溶液中不可能存在c(Na+)>c(OH-)>c(A-)>c(H+) | |
| C. | 溶液中可能存在c(Na+)>c(A-)>c(H+)>c(OH-) | |
| D. | 若溶质为NaA和HA,则一定存在c(A-)>c(Na+)>c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等于80% | B. | 略小于80% | C. | 略大于80% | D. | 等于20% |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com