
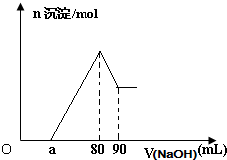
 将一块镁铝合金投入一定体积的1mol/L稀盐酸中,待合金完全溶解后往溶液里滴入1mol/L的NaOH溶液,生成沉淀物质的量与加入NaOH溶液体积的关系如图.下列说法中不正确的是( )
将一块镁铝合金投入一定体积的1mol/L稀盐酸中,待合金完全溶解后往溶液里滴入1mol/L的NaOH溶液,生成沉淀物质的量与加入NaOH溶液体积的关系如图.下列说法中不正确的是( )| A. | 由图可以确定该镁铝合金中铝的质量为0.27 g | |
| B. | 由图可以确定该合金中两元素的物质量之比的最大值为4 | |
| C. | 当滴入1mol/L的NaOH溶液85mL时,所得沉淀的成分为Mg(OH)2和Al(OH)3 | |
| D. | 由图可以确定a的取值范围为:0≤a≤50 |
分析 A.根据氢氧化钠的体积在80至90ml段内,所有的氢氧化钠用于溶解氢氧化铝,根据氢氧化钠的量确定氢氧化铝的量,根据原子守恒确定金属铝的量;
B.根据图象中消耗的氢氧化钠的量确定合金中金属镁的最大量,进而确定该合金中两元素物质的量之比的最大值;
C.当加入1mol/L的NaOH溶液85mL时,只有5ml用于氢氧化铝的溶解;
D.合金的组成可以采用极限假设法,当金属全部是金属铝时剩余的酸最多,a的值最大来判断a得取值范围.
解答 解:A.根据图可知,首先发生的反应是中和过量的酸:H++OH-=H2O,然后是沉淀两种金属离子:Mg2++2OH-=Mg(OH)2↓、Al3++3OH-=Al(OH)3↓,最后是Al(OH)3的溶解:Al(OH)3+OH-=[Al(OH)4]-,从横坐标80mL到90mL这段可以求出n(Al(OH)3)=0.01mol,则n(Al)=n(Al(OH)3)=0.01mol,即为0.27g,故A正确;
B.n(Al)=n(Al(OH)3)=0.01mol,所以沉淀Al3+需要的OH-为0.03mol,即NaOH溶液的体积为30mL,镁离子和铝离子沉淀完全消耗的碱的体积为80-a,若假设盐酸不剩,所以沉淀Mg2+需要NaOH溶液的体积最大值为50mL,求出n (Mg)的最大值为0.025mol,所以该合金中镁铝两元素物质的量之比的最大值为2.5,故B错误;
C.当加入1mol/L的NaOH溶液85mL时,发生反应:Al(OH)3+OH-=[Al(OH)4]-,只有5ml用于氢氧化铝的溶解,氢氧化铝剩余,所得沉淀的成分为Mg(OH)2和Al(OH)3,故C正确;
D.假设盐酸溶解金属后不剩,这种情况下,酸恰好与合金反应完全,即a=0,通过极值法,当合金中完全是铝时,因为沉淀Al3+需要NaOH溶液的体积为30mL,从图可知,中和过量的酸所消耗的碱液体积最大为50mL,但是假设不成立,最大值是不存在的,所以的取值范围为 0≤a<50,故D错误.
故选BD.
点评 本题以图象分析为载体考查了镁、铝的性质,明确图象中各个拐点的溶质、沉淀分别是什么是解本题关键,注意结合极限法分析解答,难度较大,侧重于考查学生的分析能力和计算能力.


科目:高中化学 来源: 题型:推断题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
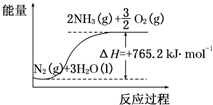 一种“人工固氮”的新方法是在常温、常压、光照条件下,N2在催化剂表面与水发生反应生成NH3:N2+3H2O?2NH3+$\frac{3}{2}$O2,进一步研究NH3生成量与温度的关系,部分实验数据见表(反应时间3h):
一种“人工固氮”的新方法是在常温、常压、光照条件下,N2在催化剂表面与水发生反应生成NH3:N2+3H2O?2NH3+$\frac{3}{2}$O2,进一步研究NH3生成量与温度的关系,部分实验数据见表(反应时间3h):| T/℃ | 30 | 40 | 50 |
| 生成NH3量/(10-6 mol) | 4.8 | 5.9 | 6.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
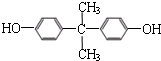
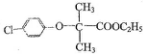 )和某聚碳酸酯工程塑料(
)和某聚碳酸酯工程塑料(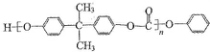 )的原料之-.
)的原料之-.
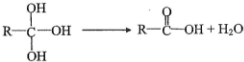
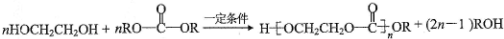
 .
. .
. .
.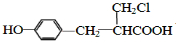 、
、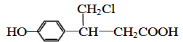 (或
(或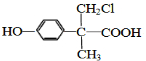 、
、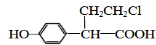 ).
).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
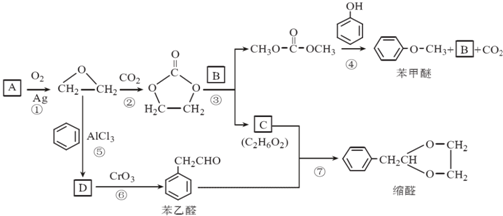
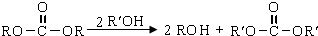
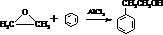 .
.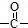 结构的苯乙醛的所有同分异构体的结构简式:
结构的苯乙醛的所有同分异构体的结构简式: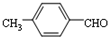 、
、 .
.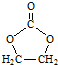 的合成路线,设计一条由2-氯丙烷和必要的无机试剂制备
的合成路线,设计一条由2-氯丙烷和必要的无机试剂制备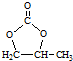 的合成路线(注明必要的反应条件)
的合成路线(注明必要的反应条件)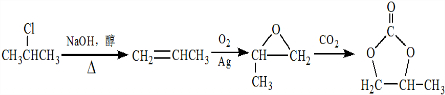 .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子中键的极性越强,分子越稳定 | |
| B. | 若把H2S写成H3S,违背了共价键的饱和性 | |
| C. | 分子中共价键的键能越大,键越长,则分子越稳定 | |
| D. | 分子中共价键的键能越大,该物质的性质越不活泼 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③ | B. | ①② | C. | ①④ | D. | ③④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com