
 (1)一定温度下,向1L 0.l mol•L-1 CH3 COOH溶液中加入0.1molCH3COONa固体,溶液中$\frac{c(C{H}_{3}CO{O}^{-}).c(H{+}^)}{c(C{H}_{3}COOH)}$不变(填“增大”、“减小”或“不变”).
(1)一定温度下,向1L 0.l mol•L-1 CH3 COOH溶液中加入0.1molCH3COONa固体,溶液中$\frac{c(C{H}_{3}CO{O}^{-}).c(H{+}^)}{c(C{H}_{3}COOH)}$不变(填“增大”、“减小”或“不变”).分析 (1)$\frac{c(C{H}_{3}CO{O}^{-})•c({H}^{+})}{c(C{H}_{3}COOH)}$为CH3COOH的电离平衡常数,只受温度的影响;
(2)①溶液的酸碱性是根据溶液中H+浓度与OH-浓度的相对大小判断的,只要溶液中c(H+)=c(OH-),溶液就呈中性,CH3COOH是弱电解质,电离程度不大,NaOH是强电解质,完全电离,反应生成的乙酸钠是强碱弱酸盐水解呈碱性,需溶液呈中性,需少加碱;根据溶液呈中性pH=7c(H+)=c(OH-)结合电荷守恒c(Na+)+c(H+)=c(CH3COO-)+c(OH-)进行解答;
②根据电荷守恒c(Na+)+c(H+)=c(CH3COO-)+c(OH-),物料守恒c(Na+)=2[c(CH3COO-)+c(CH3COOH)]进行解答;
(3)①从图中可以看出,既含HCO3-又含CO32-的pH范围为8-12;
实验方案是否可行,关键看根据测量数据能否计算出结果.
A.此方案利用碳酸氢钠的不稳定性,利用差量法即可计算质量分数;
B.根据钠守恒,可列方程组求解;
C.应先把水蒸气排除才合理;
D.根据质量关系,可列方程组求解.
②溶液中含量最大的三种离子有Na+、Cl-、HCO3-,钠离子与氯离子浓度相等,HCO3-浓度最大时是钠离子和氯离子浓度的$\frac{1}{2}$;
解答 解:(1)$\frac{c(C{H}_{3}CO{O}^{-})•c({H}^{+})}{c(C{H}_{3}COOH)}$为CH3COOH的电离平衡常数,只受温度的影响,所以不变,故答案为:不变;
(2)①CH3COOH是弱电解质,电离程度不大,NaOH是强电解质,完全电离,反应生成的乙酸钠是强碱弱酸盐,水解呈碱性,需溶液呈中性pH=7,需少加碱,所以常温下,将V mL、0.1000mol•L-1氢氧化钠溶液逐滴加入到20.00mL、0.1000mol•L-1醋酸溶液中,充分反应,V<20.00mL溶液呈中性pH=7,c(H+)=c(OH-);根据电荷守恒c(Na+)+c(H+)=c(CH3COO-)+c(OH-),c(H+)=c(OH-),溶液中的溶质为乙酸钠溶液,水的电离是微弱的,所以c(Na+)=c(CH3COO-)>c(H+)=c(OH-),
故答案为:<;c(Na+)=c(CH3COO-)>c(H+)=c(OH-);
②根据电荷守恒c(Na+)+c(H+)=c(CH3COO-)+c(OH-),物料守恒c(Na+)=2[c(CH3COO-)+c(CH3COOH)],得到c(H+)+c(CH3COO-)+2c(CH3COOH)=c(OH-),则c(OH-)-c(H+)-c(CH3COOH)=c(CH3COO-)+c(CH3COOH),反应后溶液的体积变为60mL,则c(CH3COO-)+c(CH3COOH)═$\frac{0.1mol/L×20mL}{60mL}$=$\frac{1}{30}$mol/L,或0.033mol/L,
故答案为:$\frac{1}{30}$或0.033;
(3)①从图中可以看出,既含HCO3-又含CO32-的pH范围为8-12,故将Na2CO3和NaHCO3混合物配成溶液,则此溶液的pH的取值范围是8<pH<12;
A.NaHCO3受热易分解生成碳酸钠、水和二氧化碳,所以通过加热分解利用差量法即可计算出Na2CO3质量分数,故A正确;
B.Na2CO3和NaHCO3均可与盐酸反应生成水、二氧化碳和氯化钠,所以bg固体是氯化钠,利用守恒法可计算出Na2CO3质量分数,故B正确;
C.混合物与足量稀硫酸充分反应,也会生成水和二氧化,所以逸出的气体是二氧化碳,但会混有水蒸气,即碱石灰增加的质量不是二氧化碳的质量,不能测定含量,故C错误;
D.Na2CO3和NaHCO3都与Ba(OH)2反应,反应的方程式为CO32-+Ba2+=BaCO3↓、HCO3-+OH-+Ba2+=H2O+BaCO3↓,因此最后得到的固体是BaCO3,所以可以计算出Na2CO3质量分数,故D正确.
故答案为:8<pH<12;ABD.
②溶液中含量最大的三种离子有Na+、Cl-、HCO3-,钠离子与氯离子浓度相等,HCO3-浓度最大时是钠离子和氯离子浓度的$\frac{1}{2}$,故答案为:c(Na+)=c(Cl-)>c(HCO3-);
点评 本题考查物质含量的实验方案的设计和离子浓度大小比较等内容,题目难度中等,注意把握物质的性质以及实验方案的原理.


 探究与巩固河南科学技术出版社系列答案
探究与巩固河南科学技术出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 利用氯化钾与碳酸钙的溶解性差异,可用溶解、过滤的方法除去碳酸钙 | |
| B. | 由于碘在酒精中的溶解度大,所以可用酒精把碘水中的碘萃取出来 | |
| C. | 水的沸点是100℃,酒精的沸点是78.5℃,所以可用加热蒸发法使含水酒精变为无水酒精 | |
| D. | 氯化钠的溶解度随温度的下降而减小,所以可用冷却法从热的含有少量氯化钾的氯化钠浓溶液中得到纯净的氯化钠晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 称取1.44g硫酸铜,配成100mL溶液 | B. | 称取2.25g胆矾,加入100mL水 | ||
| C. | 称取1.6g硫酸,加入100mL水 | D. | 称取2.5g胆矾,配成100mL溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.5L | B. | 0.1L | C. | 2L | D. | 1L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 体积:②>③>①>④ | B. | 物质的量:②>③>④>① | ||
| C. | 质量:②>③>①>④ | D. | 氢原子个数:①>③>④>② |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | >100 mL | B. | =100 mL | C. | <100 mL | D. | 不能确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ,丁分子的结构式为H-$\stackrel{\stackrel{H}{/}}{N}$-$\stackrel{\stackrel{H}{/}}{N}$-H,丙属于极性分子(填“极性”或“非极性”)
,丁分子的结构式为H-$\stackrel{\stackrel{H}{/}}{N}$-$\stackrel{\stackrel{H}{/}}{N}$-H,丙属于极性分子(填“极性”或“非极性”)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
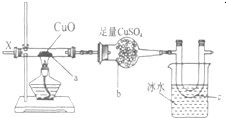 按图装置,持续通入X气体,可以看到a处有红色物质生成,b处变蓝,c处得到刺激性气味的液体,则X气体可能是( )
按图装置,持续通入X气体,可以看到a处有红色物质生成,b处变蓝,c处得到刺激性气味的液体,则X气体可能是( )| A. | ①③ | B. | ① | C. | ③④ | D. | ⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com