
【题目】NA为阿伏加德罗常数的数值,下列叙述错误的是( )
A. 18gH2O中含有的质子数为10NA
B. 1.0L1.0mo1·L-1的NaAlO2水溶液中含有的氧原子数为2NA
C. 46gNO2和N2O4混合气体中含有原子总数为3NA
D. 1molNa与足量O2反应,生成Na2O和Na2O2的混合物,钠失去NA个电子
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】下列有关物质结构和性质的说法不正确的是( )
A. 分子式为C5H9O2Cl且能与饱和NaHCO3溶液反应产生气体的有机物有12种(不含立体结构)
B. 已知引发某疫情的病毒对化学药品很敏感,乙醇、漂白粉溶液均可将病毒氧化而达到消毒的目的
C. 一定条件下,完全燃烧14g含氧质量分数为a的乙烯、乙醛混合气体,则生成水的质量为18(1-a)g
D. 按系统命名法,化合物![]() 的名称为3-甲基-5,7-二乙基癸烷
的名称为3-甲基-5,7-二乙基癸烷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)等温、等压下,等体积的O2和O3所含分子个数比______,质量比为_______。
(2)已知16 g A和20 g B恰好完全反应生成0.04 mol C和31.76 g D,则C的摩尔质量为_____。
(3)在三个密闭容器中分别充入Ne、H2、O2三种气体,当它们的温度和密度都相同时,这三种气体的压强(p)分别用p(Ne)、p(H2)、p(O2)表示,由大到小的顺序是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2和I2在一定条件下能发生反应:H2(g)+I2(g) ![]() 2HI(g) △H=-a kJ/mol.已知:
2HI(g) △H=-a kJ/mol.已知:
![]() (a、b、c均大于零)。
(a、b、c均大于零)。
下列说法正确的是
A.H2、I2和HI分子中的化学键都是非极性共价键
B.断开2 mol HI分子中的化学键所需能量约为(c+b+a) kJ
C.相同条件下,1 mol H2 (g)和1mol I2 (g)总能量小于2 mol HI (g)的总能量
D.向密闭容器中加入2 mol H2 (g)和2 mol I2 (g),充分反应后放出的热量为2a kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外小组的同学拟用下图所示的装置从含碘废液(除H2O外,还有I2、I-等)中回收碘。回答下列问题:

(1)装置A中发生反应的离子方程式为________。
(2)仪器X的名称为________;装置D的作用是________。
(3)装置C中球形冷凝管冷却水从________(填“a”或“b”)进入,反应控制在较低温度下且保持溶液pH =2进行,其主要原因是________。
(4)三口烧瓶中液体经过滤得粗碘,粗碘可经________(填操作名称)得到纯碘。
(5)为测定某含碘废水中I2的含量,取样l00mL,调节溶液pH后,滴加2滴淀粉溶液,然后用0.02500mol/LNa2S2O3标准溶液滴定,消耗标准液18.15mL。则滴定终点时的现象为________,含碘废水中I2的含量=________mg/mL(结果保留小数点后三位,已知:I2 +2S2O32-=2I-+S4O62-)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下面的反应路线及所给信息填空:

(1)A的结构简式是_____________,名称是_______________________;
(2)①的反应类型______________,②的反应类型__________________;
(3)反应②的化学方程式_______________________________;
反应④的化学方程式______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为验证卤素单质氧化性的相对强弱,某小组用下图所示装置进行实验(夹持仪器已略去,气密性已检验)。

实验过程:
Ⅰ.打开弹簧夹,打开活塞a,滴加浓盐酸。
Ⅱ.当B和C中的溶液都变为黄色时,夹紧弹簧夹。
Ⅲ.当B中溶液由黄色变为棕红色时,关闭活塞a。
Ⅳ.……
(1)验证氯气的氧化性强于碘的实验现象是_________________________________________。
(2)B中溶液发生反应的离子方程式是____________________________________________。
(3)为验证溴的氧化性强于碘,过程Ⅳ的操作和现象是________________________________。
(4)过程Ⅲ实验的目的是_________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E五种元素都是前36号元素,原子序数依次增大,其相关信息如下表:
元素 | 相关信息 |
A | A的第一电离能低于同周期左右相邻元素 |
B | B原子中成对电子数等于未成对电子数的2倍 |
C | C原子p轨道和s轨道中的电子数相等,与非金属的原子结合时形成共价键 |
D | D与A、B、C均不同周期,其一个单质分子中只有一个σ键 |
E | E的原子序数比所处周期中未成对电子数最多的元素大3 |
(1)写出上述一种元素与氢元素形成的X2Y2型非极性分子的结构式:_______.
(2)写出E元素的元素符号:______,其价电子排布图为:_______.
(3)A与D形成化合物的化学式为 __,是_______分子(填“极性”或“非极性”)
(4)在ETiO3晶胞中(结构如图所示),1个Ti原子和1个E原子周围距离最近的O原子数目分别为__个、__个.
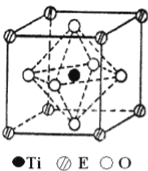
(5)叠氮酸(HN3)是一种弱酸,可部分电离出H+和N3﹣.N3﹣的空间构型为______,叠氮化物能与E3+形成配合物,则[E(N3)(NH3)5]SO4中配体是_____,E的配位数是_____.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com