
【题目】硝酸银是中学实验室常用试剂。硝酸银不稳定,易发生如下反应:
①2AgNO3(s)= 2Ag(s)+ 2N02(g)+O2(g) △H1
②2NO2(g)![]() N2O4(g) △H2
N2O4(g) △H2
(1)2AgNO3(s)= 2Ag(s)+N2O4(g)+O2(g) △H=___________(用含△H1、△H2的式子表示)。
(2)实验室配制硝酸银溶液的操作方法是:将一定量硝酸银固体溶于浓硝酸中,加水稀释至指定体积。“硝酸”的作用是____________________________________________。
(3)一定温度下,在5L的恒容密闭容器中投入34 g AgNO3(s)并完全分解测得混合气体的总物质的量(n)与时间(t)的关系如图所示。
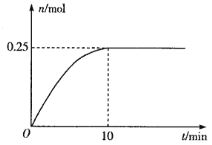
①下列情况能说明体系达到平衡状态的是___________(填字母)
a.Ag粉的质量不再改变 b.O2的浓度不再改变
c.NO2的体积分数不再改变 d.混合气体的密度不再改变
②反应开始到10min内N2O4的平均反应速率为___________mol·L-1·min-1。
③若达到平衡时,混合气体的总压强p=3.0MPa。在该温度下2NO2(g)![]() N2O4(g)的平衡常数Kp=___ (MPa)-1(结果保留2位小数)。[提示:用平衡时各组分分压替代浓度计算的平衡常数叫压强平衡常数(Kp),组分的分压(P1)=平衡时总压(P)×该组分的体积分数(
N2O4(g)的平衡常数Kp=___ (MPa)-1(结果保留2位小数)。[提示:用平衡时各组分分压替代浓度计算的平衡常数叫压强平衡常数(Kp),组分的分压(P1)=平衡时总压(P)×该组分的体积分数(![]() )]
)]
④达到平衡后,再向容器中充入少量的NO2,平衡2NO2(g)![]() N2O4(g)___________(填“向左”“向右”或“不”)移动,NO2的平衡转化率___________(填“增大”“减小”或“不变”)。
N2O4(g)___________(填“向左”“向右”或“不”)移动,NO2的平衡转化率___________(填“增大”“减小”或“不变”)。
(4)已知几种难溶物的溶度积如下表所示:
难溶物 | AgI | AgSCN | AgCl | Ag2CrO4 | Ag2S |
溶度积 | 8.5×10-17 | 1.2x10-12 | 1.8×10-10 | 1.1×10-11 | 6.7×10-50 |
颜色 | 黄色 | 白色 | 白色 | 红色 | 黑色 |
实验室常用AgNO3溶液滴定Cl-,宜选择___________作指示剂(填字母)
A.KI B. NH4SCN C. Na2CrO 4 D.K2S
(5)工业上,常用电解法精炼粗银。粗银中含有Cu、Au等杂质,用AgNO3溶液作电解质溶液。若以电流强度aA,通电bmin后,制得精银的质量为ckg,则该精炼装置的电流效率为___________(只要求列出计算式即可)。[已知:1mol电子带96500C(库仑)电量,电流效率等于阴极得电子数与通过电子总数之比]
【答案】△H1+△H2 抑制Ag+水解 c 0.001 0.42 向右 增大 C 1000c×96500/(108×60ab)
【解析】
本题考查盖斯定律的使用;化学反应速率及化学平衡常数的计算;难溶物溶解平衡问题;电解池的有关计算。
(1)①2AgNO3(s)=2Ag(s)+2NO2(g)+O2(g) △H1
②2NO2(g) ![]() N2O4(g) △H2
N2O4(g) △H2
结合盖斯定律,方程式①+方程式②即可得到目标方程式,则2AgNO3(s)=2Ag(s)+N2O4(g)+O2(g) △H=△H1+△H2; 故答案为:△H1+△H2;
(2)硝酸银溶液中硝酸银易水解:Ag++H2O![]() AgOH+H+,配制过程中加入硝酸可以抑制水解,故答案为:抑制Ag+水解;
AgOH+H+,配制过程中加入硝酸可以抑制水解,故答案为:抑制Ag+水解;
(3)①反应过程中,该物理量若发生变化,最终不再发生变化,则可以作为判断判断平衡的依据:a.Ag粉质量不再变化,只能说明AgNO3完全分解,不能说明反应达到平衡状态,故a错误;b.氧气浓度不再改变,只能说明AgNO3完全分解,不能说明反应达到平衡状态,故b错误;c.NO2的体积分数与气体总体积有关,气体总体积不变则NO2的体积分数不变,则NO2的体积分数不再变化可以说明反应达到平衡状态,故c正确;d.反应过程中容器体积不变,只要AgNO完全分解,气体总质量就保持不变,气体密度就不变,则气体密度不再变化不能说明反应达到平衡状态,故d错误。该题答案为c。
②n(AgNO3)=m/M=34g÷170g·mol-1=0.2mol,结合方程式①2AgNO3(s)= 2Ag(s)+ 2N02(g)+O2(g),得到生成气体总物质的量为0.3mol,其中O2为0.1mol;因为②2NO2(g)![]() N2O4(g)气体物质的量变少,结合图像可知10min达到平衡时气体总物质的量为0.25mol,结合物质的量差可知生成的N2O4为0.05mol,依据反应速率公式υ(N2O4)=0.05mol÷5L÷10min=0.001mol/(L·min)。故答案为:0.001 。
N2O4(g)气体物质的量变少,结合图像可知10min达到平衡时气体总物质的量为0.25mol,结合物质的量差可知生成的N2O4为0.05mol,依据反应速率公式υ(N2O4)=0.05mol÷5L÷10min=0.001mol/(L·min)。故答案为:0.001 。
③ 2NO2(g) ![]() N2O4(g)
N2O4(g)
起始:0.2mol 0
转化:0.1mol 0.05mol
平衡:0.1mol 0.05mol
同时体系中还有0.1mol氧气,P(NO2)=3MPa×![]() =1.2 MPa,P(N2O4)=3MPa×
=1.2 MPa,P(N2O4)=3MPa×![]() =0.6 MPa,推得Kp=0.6MPa÷(1.2MPa)2=0.42 (MPa)-1,故答案为:0.42 ;
=0.6 MPa,推得Kp=0.6MPa÷(1.2MPa)2=0.42 (MPa)-1,故答案为:0.42 ;
④再充入二氧化氮,导致二氧化氮浓度增大,平衡正移;恒容容器且反应物只有一种,当充入反应物时压强增大,平衡正移,转化率增大,故答案为:向右;增大。
(4)结合题干可以分析得到,用AgNO3溶液滴定Cl-,应先生成氯化银沉淀,当氯离子完全沉淀时,产生另一种有别于氯化银沉淀颜色的沉淀。故答案为:C。
(5)阴极电极反应式为Ag++e-=Ag,阴极得电子:1000c/108mol;电路中通过的电子:60ab/96500mol,精炼池的电流效率为1000c/108mol÷(60ab/96500mol)=1000c×96500/(108×60ab);故答案为:1000c×96500/(108×60ab)。


 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案科目:高中化学 来源: 题型:
【题目】化学实验室必须有严格的规章制度和科学的管理方法。回答下列问题:
(1)危险化学品标志可以表示化学药品的危险性类别,硝酸应使用下列标志中的_____(填标号)。

(2)钾、钠、镁等活泼金属着火时,下列物品可用来灭火的是__________(填标号)。
A.水 B.细沙 C.泡沫灭火器 D.二氧化碳灭火器
除了选择的物品外,不能使用上述其他物品扑灭钾、钠、镁等活泼金属着火的原因是_________________。
(3)下列对药品的保存方法正确的是_________ (填标号)。
①将高锰酸钾与乙醇存放在同一橱柜中
②保存液溴时向其中加入少量水
③用玻璃细口瓶盛装氢氟酸
④用带橡皮塞的玻璃试剂瓶盛装汽油
⑤用棕色玻璃细口瓶盛装浓硝酸
(4)NaCN属于剧毒化学品,应与酸类、氧化剂、食用化学品分开存放。其阴离子CN-中各原子均满足8电子稳定结构,NaCN的电子式为______;NaCN溶液显碱性,原因是_____________(用离子方程式表示);强氧化剂NaC1O会将CN-氧化,生成N2、CO32-和C1-等无毒无害物质,可用该反应处理含氰废水(破氰),反应的离子方程式为_____________。若用一定量NaC1O处理浓缩后的含氰废水10L[c(CN-)=0.2mol/L],过程中产生标准状况下21 L氮气,则该过程的破氰率达到_________%。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上通过电解精制饱和食盐水来制备NaOH、H2、Cl2,再合成盐酸。完成下列填空:
(1)粗盐提纯:为除去粗盐中的Ca2+、Mg2+、SO42—。向粗盐溶液中依次加入稍过量的NaOH溶液、______,过滤后,再向滤液中加入适量__________,再蒸发。
(2)电解饱和食盐水:25℃,电解10L饱和食盐水,若阴极收集到标准状况下11.2L_______(填气体化学式),则溶液pH=_______(设溶液体积、温度不变、忽略生成物间的反应)。
(3)工业制盐酸:利用Cl2和H2化合,所得产物再溶于水的方法制得盐酸,生产流程如下:

为确保Cl2完全反应,合成塔中n(H2)略大于n(Cl2)。写出一条Cl2必须反应完全的理由:______。
(4)盐酸浓度测定:可用滴定法,用盐酸滴定已知质量Na2CO3的溶液。过程如下:准确称量一定质量的Na2CO3固体于锥形瓶中,加蒸馏水使其溶解,滴加指示剂X,用待测盐酸滴定,接近终点时,加热锥形瓶,煮沸液体2min,冷却至室温,继续滴定至终点,记录消耗盐酸的体积。重复上述过程三次,计算盐酸浓度。
已知:指示剂X的变色范围是5.0~5.2; 25℃,饱和CO2水溶液pH≈4。
①本测定用的仪器有锥形瓶、烧杯、玻璃棒、____________________________________。
②本测定的反应原理是________________________________(用化学方程式表示)。
③接近终点时煮沸反应混合物的目的是_______________________________。
④盛放Na2CO3固体的锥形瓶不干燥,对实验结果的影响是_________(填“偏大”、“偏小”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】食品化学家A.SaariCsallany和Christine Seppanen研究发现,当豆油被加热到油炸温度(185 ℃)时,会产生如下所示高毒性物质,许多疾病和这种有毒物质有关,如帕金森症。下列关于这种有毒物质的判断不正确的是

A. 该物质属于烃的衍生物
B. 该物质的分子式为C9H14O2
C. 该物质分子中含有三种官能团
D. 该物质最多可以和2 mol H2发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:2H2(g)+O2(g) ===2H2O(l) ΔH=-571.66 kJ·mol-1
CO(g)+1/2O2(g) ===CO2(g) ΔH=-282.9 kJ·mol-1
若氢气与一氧化碳的混合气体完全燃烧可生成2.7 g H2O(l),并放出57.02 kJ热量,则混合气体中CO的物质的量约为( )
A. 0.22 mol B. 0.15 mol C. 0.1 mol D. 0.05 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,充分燃烧一定量的丁烷生成二氧化碳和气态水时放出热量Q kJ(Q>0)。经测定完全吸收生成的CO2需消耗5 mol·L-1的KOH溶液100 mL,恰好生成正盐。则此条件下反应C4H10(g)+13/2O2(g)![]() 4CO2(g)+5H2O(g)的ΔH为( ) kJ·mol-1
4CO2(g)+5H2O(g)的ΔH为( ) kJ·mol-1
A. +8Q B. +16Q C. -8Q D. -16Q
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生产、生活密切相关,下列说法不正确的是( )
A. 用报纸包装食物属于资源的充分利用,应以提倡。
B.  是矿泉水瓶、饮料瓶底的常见标志,表示可回收利用,只能一次性使用,不能长期使用。
是矿泉水瓶、饮料瓶底的常见标志,表示可回收利用,只能一次性使用,不能长期使用。
C. 具有吸水性的植物纤维加工后可用作食品干燥剂。
D. 防伪荧光油墨由颜料与树脂连接料等制成,其中树脂属于有机高分子材料。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关反应事实描述不正确的是
A.灼热的木炭与 CO2反应,反应物总能量低于生成物总能量
B.发生铝热反应时,铝粉与 Fe2O3需要在高温下反应,所以该反应是吸热反应
C.镁条和盐酸反应时,溶液的温度通常会上升
D.氢氧化钡晶体和氯化铵晶体的反应是吸热反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com