
����Ŀ��700��ʱ��H2��g����CO2��g��![]() H2O��g����CO��g�������¶��£��ڼס��ҡ������������ܱ������У�Ͷ��H2��CO2����ʼŨ�����±���ʾ�����м�2min��ƽ��ʱ��v (H2O)Ϊ0.025 mol/��L��min���������жϲ���ȷ���ǣ� ��
H2O��g����CO��g�������¶��£��ڼס��ҡ������������ܱ������У�Ͷ��H2��CO2����ʼŨ�����±���ʾ�����м�2min��ƽ��ʱ��v (H2O)Ϊ0.025 mol/��L��min���������жϲ���ȷ���ǣ� ��
��ʼŨ�� | �� | �� | �� |
C��H2��/mol/L | 0.1 | 0.2 | 0.2 |
C��CO2��/mol/L | 0.1 | 0.1 | 0.2 |
A. ƽ��ʱ������CO2��ת���ʴ���50��
B. ����Ӧƽ��ʱ������c��CO2���Ǽ��е�2��
C. �¶�����800�棬������Ӧƽ�ⳣ��Ϊ25/16��������ӦΪ���ȷ�Ӧ
D. �����������䣬����ʼʱ���������г���0.10mol/L H2��0.20 mol/L CO2������ƽ��ʱc (CO)���Ҳ�ͬ
���𰸡�D
��������A����װ��������H2O�����ʵ���Ũ��Ϊ0.025��2mol��L��1=0.05mol��L��1���������CO2���ʵ���Ũ��Ϊ0.05mol��L��1����CO2��ת����Ϊ0.05/0.1��100%=50%����װ���൱���ڼĻ���������0.1mol��L��1��H2��ƽ��������Ӧ�����ƶ���CO2��ת������������CO2��ת���ʴ���50%����A˵����ȷ��B�����ݻ�ѧ��Ӧ����ʽ����Ӧǰ������ϵ��֮����ȣ���˼ͱ�Ϊ��Чƽ�⣬��װ����c(CO2)�Ǽ���2������B˵����ȷ��C��
H2��g����CO2��g��![]() H2O��g����CO��g��
H2O��g����CO��g��
��ʼ�� 0.1 0.1 0 0
�仯�� 0.05 0.05 0.05 0.05
ƽ�⣺ 0.05 0.05 0.05 0.05 ���ݻ�ѧƽ�ⳣ���ı���ʽ��700��ʱ�Ļ�ѧƽ�ⳣ��Ϊ0.05��0.05/(0.05��0.05)=1<25/16��˵�������¶ȣ�ƽ��������Ӧ�����ƶ���������������ԭ��������Ӧ����Ϊ���ȷ�Ӧ����C˵����ȷ��D����Ϊ��Ӧǰ������ϵ��֮����ȣ��������ƽ����c(CO)��ͬ����D˵������


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��±��Ԫ���Ƿǽ����Ժ�ǿ��һ��Ԫ�أ����γɶ������ʡ�
(1)���������������ֻ�ԭ��,ͬʱ���ʵ��������ֿɷ�������������ԭ��Ӧ��
�ٽ�����������ͨ�뵽H2S��Һ�У��������õ���Һ�м����������ữ��BaCl2��Һ�ɵõ���ɫ����,д��ǰһ����Ӧ�����ӷ���ʽ��____________________________��
�ڽ�0.1molCl2����ͨ�뵽amL��Ũ��Ϊ2mol/L��KOH��Һ�У�����ǡ�÷�Ӧ��,�����Һc(ClO-)��c(ClO3-)��c(Cl-)=2��1��7,��a=______________��
(2)KClO3��һ����Ҫ��������,��ҵ���Ʊ�KClO3�ķ���֮һ���£�
![]()
��д�����ʱ��Ӧ�Ļ�ѧ����ʽ��_______________________________��
����ͬ�¶���,���������ε��ܽ����Դ�С��NaClO3___________KClO3(�>����<��)��
��KClO3��MnO2�Ĵ������¼��ȷֽ����������ķ�Ӧ�������£�����д�հ״���
2KClO3+2MnO2![]() 2KMnO4+Cl2��+O2��;
2KMnO4+Cl2��+O2��;
2KMnO4![]() K2MnO4+MnO2+O2����
K2MnO4+MnO2+O2����
K2MnO4+Cl2![]() O2��+___________+___________��
O2��+___________+___________��
��Ӧ��������������뿪����Ҫ������__________________________��
(3)��֪Cl2O������������,��Cl2Oͨ�뵽ˮ�пɵõ�һ��������Һ����д������Һ���еij��������һ�ֻ�ѧ����______________������������ͨ�뵽NaOH��Һ��ǡ����ȫ��Ӧ,����Һ�и�����Ũ���ɴ�С��˳��Ϊ______________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ǽ������ϵ����ǣ���������������Լռ�ؿ�������90%���ϡ�
(1)SiO2�Dz����ijɷ�֮һ��SiO2������������Һ��Ӧ�Ļ�ѧ����ʽΪ______________________________������ʦ����________(����������)����̲�����
(2)��Na2SiO3��Һ���ݹ���������ȼ�գ�����Na2SiO3����;����________��ԭ�ϡ�
(3)��ҵ�ϳ���2C��SiO2![]() Si��2CO���Ʊ��赥�ʣ��÷�Ӧ����Ԫ�ػ��ϼ����ߵ�������________(�ѧʽ����ͬ)����������________��
Si��2CO���Ʊ��赥�ʣ��÷�Ӧ����Ԫ�ػ��ϼ����ߵ�������________(�ѧʽ����ͬ)����������________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���۲�����A��B��C��D��E�������ӣ�ԭ�ӻ����ӣ��Ľṹʾ��ͼ���ش��й����⣺
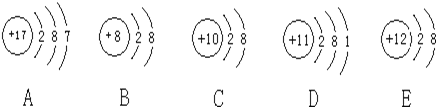
��1���������ӽṹʾ��ͼ����______��______�����ţ���
��2���������ȶ���ԭ���ǣ���д��ţ��ڱ�С������ͬ��______��������ʧȥ���ӵ�ԭ����______�������õ����ӵ�ԭ����______��
��3��A��D����Ԫ���γɵĻ�������ˮ��Һ�еĵ��뷽��ʽ______��
��4���ں˵����1-18��Ԫ���ڣ��о�������B������Ӳ��Ų���ͬ�����ӣ�д�����ӵķ���______��______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��2SO2(g)+ O2(g) ![]() 2SO3(g)�ǹ�ҵ���������Ҫ��Ӧ֮һ��һ���¶��£��ڼס��ҡ��������ݻ���Ϊ2L�ĺ����ܱ�������Ͷ��SO2(g)��O2(g)������ʼ���ʵ�����SO2��ƽ��ת�������±���ʾ�������ж���ȷ����
2SO3(g)�ǹ�ҵ���������Ҫ��Ӧ֮һ��һ���¶��£��ڼס��ҡ��������ݻ���Ϊ2L�ĺ����ܱ�������Ͷ��SO2(g)��O2(g)������ʼ���ʵ�����SO2��ƽ��ת�������±���ʾ�������ж���ȷ����
�� | �� | �� | ||
��ʼ���ʵ��� | n(SO2)/mol | 0.4 | 0.8 | 0.8 |
n(O2)/mol | 0.24 | 0.24 | 0.48 | |
SO2��ƽ��ת����/% | 80 | ��1 | ��2 |
A. ���з�Ӧ��ƽ�ⳣ��С����
B. ���¶��£�ƽ�ⳣ��ֵΪ400
C. ƽ��ʱ������c(SO3)�Ǽ��е�2��
D. ƽ��ʱ������O2��ת���ʴ�������O2��ת����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��2015��11��30�յ�21�����Ϲ��������ڰ����ٿ��������һ������������������š���ͼ�ǿ�ѧ�������з���ʵ��CO2��H2�ϳɼ״���ȼ�յ�ء�����������ȷ����
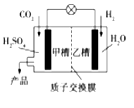
A���Ҳ��з�Ӧ����ˮ
B���ײ��еĵ缫��ӦʽΪ��CO2+6e-+5H2O=CH3OH+6OH-
C�����Ӵ��Ҳ�ͨ�����ӽ���Ĥ����ײ�
D���ŵ�����У��Ҳ۵ĵ缫������Һ��pH����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ģ��绯ѧ��Ӧװ��ͼ������˵����ȷ����( )
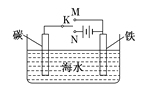
A. ����K����N���������缫�ĵ缫��ӦʽΪ��Fe��2e��=Fe2��
B. ����K����N�������Լ������ĸ�ʴ
C. ����K����M���������缫�ĵ缫��ӦʽΪ�� 2Cl����2e��=Cl2��
D. ����K����M�������Ӵ�̼��������K��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����t ��ʱ����a g NH3��ȫ����ˮ���õ�V mL��Һ���������Һ���ܶ�Ϊ�� g��mL��1�����ʵ���������Ϊw�����к���NH4+�����ʵ�����b mol������������ȷ���ǣ� ��
A. ���ʵ���������w��![]() ��100%
��100%
B. ���ʵ����ʵ���Ũ��c��![]() mol��L��1
mol��L��1
C. ��Һ��c(OH��)��![]() mol��L��1��c(H��)
mol��L��1��c(H��)
D. ��������Һ�м���V mLˮ��������Һ��������������0.5w
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������Ѳ��ֱ�����Ϊ����������������Ʒ5.4g����40gˮ�У��ڱ�״���·ų�1.12��H2 ����
(1)��Ʒ�н����Ƶ�����Ϊ____________��.
(2)����Ӧ����Һ�����Ϊ40mL��������Һ�����ʵ���Ũ��Ϊ_______mol/L
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com