
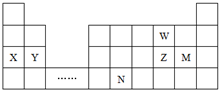
| A. | 原子半径:Y>Z>W | |
| B. | 单质的还原性:X>Y | |
| C. | 溴与元素M同主族,最高价氧化物的水化物的酸性比M的强 | |
| D. | 元素N位于金属与非金属的分界线附近,可以推断N元素的单质可作半导体材料 |
分析 由元素在周期表的位置可知,W、X、Y、Z、M、N六种主族元素分别为O、Na、Mg、S、Cl、Ge,
A.电子层越多,原子半径越大,同周期从左到右原子半径减小;
B.同周期从左向右金属性减弱;
C.非金属性越强,最高价氧化物的水化物的酸性越强;
D.元素N位于金属与非金属的分界线附近,具有金属性和非金属性.
解答 解:由元素在周期表的位置可知,W、X、Y、Z、M、N六种主族元素分别为O、Na、Mg、S、Cl、Ge,
A.电子层越多,原子半径越大,同周期从左到右原子半径减小,则原子半径:Y>Z>W,故A正确;
B.同周期从左向右金属性减弱,还原性减弱,则单质的还原性:X>Y,故B正确;
C.溴与元素M同主族,非金属性M>Br,最高价氧化物的水化物的酸性M的强,故C错误;
D.元素N位于金属与非金属的分界线附近,具有金属性和非金属性,则N元素的单质可作半导体材料,故D正确;
故选C.
点评 本题考查位置、结构与性质的关系,为高频考点,把握元素的位置、性质、元素周期律等为解答的关键,侧重分析与应用能力的考查,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
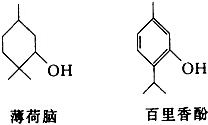 下列物质是几种常见香精的主要成分:
下列物质是几种常见香精的主要成分: .
.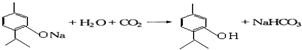 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某试样焰色反应呈黄色,则试样中含有K+ | |
| B. | 广泛pH试纸测得某碱性溶液的pH为12.5 | |
| C. | 容量瓶不能用作溶解物质的容器 | |
| D. | 粗盐的提纯试验中,滤液在坩埚中加热蒸发结晶 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:Y>X,离子半径Z<W | |
| B. | 元素Y的单质能与元素X的最高价氧化物发生置换反应 | |
| C. | 元素Y和W能形成YW2型离子化合物 | |
| D. | W的单质有毒,能使湿润的有色布条褪色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com