D
分析:A、根据精炼铜的原理和电极反应计算分析;
B、依据碘化氢和氯气能发生氧化还原反应,结合化学方程式计算分析;
C、质量换算物质的量结合分子式,利用质量数=中子数+质子数进行计算;
D、质量换算物质的量计算固体中所含离子数.
解答:A、精炼铜阳极为粗铜发生电极反应为Cu-2e
-=Cu
2+、Fe-2e
-=Fe
2+、Zn-2e
-=Zn
2+、Ni-2e
-=Ni
2+;阴极反应:Cu
2++2e
-=Cu,阴极增重6.4g时物质的量为0.1mol,电子转移为0.2mol,故A错误;
B、0.5molHI气体和0.5mol氯气混合后发生反应:2HI+Cl
2=I
2+2HCl,0.5molHI全部反应需要Cl
20.25mol,生成HCl的物质的量为0.5mol,剩余Cl
20.25mol,生成的I
2在通常状况下为固体,剩余生成的气体物质的量为0.75mol,故B错误;
C、18g
2H
218O物质的量为
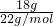
,所含的中子数为
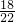
mol×(1×2+18-8)×N
A=9.8N
A,故C错误;
D、53g碳酸钠固体物质的量为
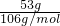
=0.5mol,含离子数为含钠离子为1mol,碳酸钙离子0.5mol,共1.5mol离子,即1.5N
A,故D正确;
故选D.
点评:本题考查了阿伏伽德罗常数的应用,主要考查粗铜精炼的原理应用,氧化还原反应的计算,质量换算物质的量,结合质量数=中子数+质子数的计算微粒数,关键是D选项是固体中的离子数计算.

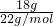 ,所含的中子数为
,所含的中子数为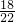 mol×(1×2+18-8)×NA=9.8NA,故C错误;
mol×(1×2+18-8)×NA=9.8NA,故C错误;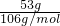 =0.5mol,含离子数为含钠离子为1mol,碳酸钙离子0.5mol,共1.5mol离子,即1.5NA,故D正确;
=0.5mol,含离子数为含钠离子为1mol,碳酸钙离子0.5mol,共1.5mol离子,即1.5NA,故D正确;

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案