
可溶性钡盐有毒,医院中常用硫酸钡这种钡盐作为内服造影剂。医院抢救钡离子中毒患者时 ,除催吐外,还需要向中毒者胃中灌入硫酸钠溶液。
,除催吐外,还需要向中毒者胃中灌入硫酸钠溶液。
已知:Ksp(BaCO3)=5.1×10-9;Ksp(BaSO4)=1.1×10-10
下 列推断正确的是( )
列推断正确的是( )
A.不用碳酸钡作为内服造影剂,是因为Ksp(BaCO3)>Ksp(BaSO4)
B.抢救钡离子中毒患者时,若没有硫酸钠,可以用碳酸钠溶液代替
C.若误饮c(Ba2+)=1.0×10-5 mol/L的溶液时,会引起钡离子 中毒
中毒
D.可以用0.36 mol/L的Na2SO4溶液给钡离子中毒患者洗胃
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
室温下,对于0.10 mol·L-1的氨水,下列判断正确的是
A.与AlCl3溶液反应发生的离子方程式为 Al3++3OH—=Al(OH)3↓
B.加水稀释后,溶液中c(NH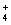 )c(OH—)变大
)c(OH—)变大
C.用HNO3溶液完全中和后,溶液不显中性
D.其溶液的PH=13
查看答案和解析>>
科目:高中化学 来源: 题型:
化学已渗透到人类生活的各个方面。下列说法错误的是
A.阿司匹林具有解热镇痛作用
B.可以用Si3N4、Al2O3制作高温结构陶瓷制品
C.禁止使用四乙基铅作汽油抗爆震剂,可减少汽车尾气污染
D.在入海口的钢铁闸门上装一定数量的铜块可防止闸门被腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
溴酸银(AgBrO3)溶解度随温度变化的曲线如图所示,下列说法错误的是( )
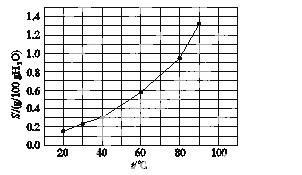
A.溴酸银的溶解是放热过程
B.温度升高时溴酸银溶解速率加快
C.60 ℃时溴酸银的Ksp约等于6×10-4
D.若硝酸钾中含有少量溴酸银,可用重结晶方法提纯
查看答案和解析>>
科目:高中化学 来源: 题型:
已知298 K时,Mg(OH)2的溶度积常数Ksp=5.6×10-12,取适量的MgCl2溶液,加入一定量的烧碱溶液达到沉淀溶解平衡,测得pH=13,则下列说法不正确的是( )
A.所得溶液中的c(H+)=1.0×10-13 mol·L-1
B.所得溶液中由水电离产生的c(OH-)=1.0×10-13 mol·L-1
C.所加的烧碱溶液的pH=1 3.0
3.0
D.所得溶液中的c(Mg2+)=5.6×10-10 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
四氯化钛(TiCl4)是制取航天航空工业材料——钛合金的重要原料。由钛铁矿(主要成分是FeTiO3)制备TiCl4等产品的一种工艺流程示意图如下:

(1)往①中加入铁屑至浸出液显紫色,此时溶液仍呈强酸性。该过程中有如下反应发生:
Fe+2Fe3+===3Fe2+
2TiO2+(无色)+Fe+4H+===2Ti3+(紫色)+Fe2++2H2O
Ti3+(紫色)+Fe3++H2O===TiO2+(无色)+Fe2++2H+
加入铁屑的作用是____________________________________________ ______________
______________
________________________________________________________________________。
(2)在②→③工艺过程中需要控制条件以形成TiO2·nH2O溶胶,该溶胶的分散质颗粒直径大小在________范围。
 (3)若把③中制得的固体TiO2·nH2O用酸清洗除去其中的杂质,还可制得钛白粉。已知25 ℃时,Ksp[Fe(OH)3]=2.79×10-39,该温度下反应Fe(OH)3+3H+Fe3++3H2O的平衡常数K=________。
(3)若把③中制得的固体TiO2·nH2O用酸清洗除去其中的杂质,还可制得钛白粉。已知25 ℃时,Ksp[Fe(OH)3]=2.79×10-39,该温度下反应Fe(OH)3+3H+Fe3++3H2O的平衡常数K=________。
(4)已知:TiO2(s)+2Cl2(g)===TiCl4(l)+O2(g)
ΔH=+140 kJ·mol-1
2C(s)+O2(g)===2CO(g) ΔH=-221 kJ·mol-1
写出④中TiO2和焦炭、氯气反应生成液态TiCl4和CO气体的热化学方程式:________。
(5)上述工艺具有成本低、可用低品位矿物为原料等优点。依据绿色化学理念,该工艺流程中存在的不足之处是__________________(只要求写出一项)。
(6)依据下表信息,要精制含少量SiCl4杂质的TiCl4,可采用________方法。
| TiCl4 | SiCl4 | |
| 熔点/℃ | -25.0 | -68.6 |
| 沸点/℃ | 136.4 | 57.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
对于0.1 mol·L-1的Na2S溶液,下列判断正确的是 ( )
A.溶液中阴离子浓度的大小顺序:c(S2-)>c(OH-)>c(HS-)
B.c(Na+)=2c(S2-)+c(OH-)+c(HS-)
C.c(OH-)=c(H+)
D.向溶液中加入少量NaHS固体,溶液中的离子种数增多
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是(NA表示阿伏加德罗常数的值):
①28 g氮气所含有的原子数目为NA
②4 g金属钙变成钙离子时失去的电子数目为0.1 NA
③在常温常压下,11.2 L N2含有的分子数为0.5 NA
④在标准状况下, 1 mol氦气含有的原子数为NA
⑤0.5 mol单质铝与足量盐酸反应转移电子数为1.5NA
⑥标准状况下,1 L水所含分子数为1/22.4NA
⑦17 g氨气所含电子数目为10NA
A.①②⑤⑥⑦ B.①②④⑤⑥ C.⑤⑦ D.④⑤⑦
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com