
【题目】等质量的铁与过量的盐酸在不同的实验条件下进行反应,测定在不同时间t产生氢气体积V的数据,根据数据绘制得到下图,则曲线a、b、c、d所对应的实验组别是
组别 | c(HCl)/molL-1 | 温度/℃ | 状态 |
1 | 2.0 | 25 | 块状 |
2 | 2.5 | 30 | 块状 |
3 | 2.5 | 50 | 粉末状 |
4 | 2.5 | 30 | 粉末状 |
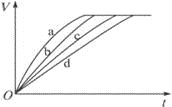
A.4-3-2-1
B.1-2-3-4
C.3-4-2-1
D.1-2-4-3
科目:高中化学 来源: 题型:
【题目】我国电池的年市场消费量约为80亿只,其中70%是锌锰干电池,利用废旧锌锰干电池制备硫酸锌晶体(ZnSO4·7H2O)和纯MnO2的工艺如下图所示:
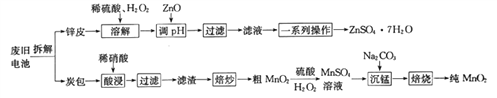
已知:
①锌皮的主要成分为Zn,含有少量Fe;炭包的主要成分为ZnCl2、NH4Cl、MnO2、碳粉等,还含有少量的 Cu、Ag、Fe 等。
②Ksp[Zn(OH)2]=2.0×10-16;Ksp[Fe(OH)2]=8.0×10-16;Ksp[Fe(OH)3]=4.0×10-38。
(1)除去炭包中碳粉的操作为_____________。
A.酸浸 B.过滤 C.焙炒 D.焙烧
(2)粗MnO2转化为MnSO4时,主要反应的离子方程式为_____________________。
(3)焙烧时发生反应的化学方程式为_____________。
(4)制备硫酸锌晶体流程中,用ZnO调节溶液pH的目的是______________________________,若溶解时不加H2O2带来的后果是____________________。
(5)“草酸钠-高锰酸钾返滴法”可测定MnO2的纯度:取agMnO2样品于锥形瓶中,加入适量稀硫酸,再加入V1mLc1mol·L-1Na2C2O4溶液(足量),最后用c2mol·L-1的KMnO4溶液滴定剩余的Na2C2O4,达终点时消耗V2 mL标准KMnO4溶液。
①MnO2参与反应的离子方程式为_____________。
②该样品中MnO2的质量分数为__________________(假定杂质不参与反应,列出表达式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaClO2广泛用于造纸工业、污水处理等,其漂白能力是漂白粉的4~5倍。工业上用ClO2气体制NaClO2的工艺流程如图:
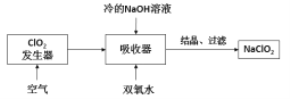
已知:NaClO2饱和溶液在低于38℃时析出NaClO23H2O,高于38℃时析出NaClO2。
下列说法不正确的是( )
A. 吸收器中生成NaClO2的离子方程式:2ClO2+2OHˉ+H2O2=2ClO2ˉ+O2+2H2O
B. 提高吸收器中的反应温度可以提高反应速率,也提高反应物的利用率
C. 流程中的结晶、过滤操作应该是蒸发结晶、趁热过滤
D. 发生器中反应结束后,向其中通入一定量空气的目的是驱赶出ClO2,使其被充分吸收
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黄铜矿(主要成分CuFeS2)是提取Cu的主要原料。
已知:2CuFeS2+4O2![]() Cu2S+3SO2+2FeO(Ⅰ)
Cu2S+3SO2+2FeO(Ⅰ)
产物Cu2S在1200 ℃高温下继续反应:2Cu2S+3O2==2Cu2O+2SO2 (Ⅱ)
2Cu2O+Cu2S==6Cu +SO2↑ (Ⅲ)
假定各步反应都完全。则下列说法正确的是
A. 反应Ⅰ中CuFeS2仅作还原剂
B. 取12.5g黄铜矿样品,经测定含3.60g硫,则矿样中CuFeS2质量分数一定为82.8%
C. 由6molCuFeS2生成6molCu消耗O2的物质的量为14.25mol
D. 6molCuFeS2和15.75molO2反应,理论上可得到铜的物质的量为3mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质在水中可能存在电离平衡、盐的水解平衡和沉淀的溶解平衡,它们都可看作化学平衡。请根据所学知识回答:
(1)A为0.1 mol·L-1的(NH4)2SO4溶液,在该溶液中各种离子的浓度由大到小的顺序为______________________________________。
(2)B为0.1 mol·L-1 NaHCO3溶液,请分析NaHCO3溶液显碱性的原因___________________________________________________。
(3)C为FeCl3溶液,实验室中配制FeCl3溶液时常加入________溶液以抑制其水解,若把B和C溶液混合,将产生红褐色沉淀和无色气体,该反应的离子方程式为___________________________。
(4)D为含有足量AgCl固体的饱和溶液,氯化银在水中存在沉淀溶解平衡:AgCl(s)![]() Ag+(aq)+Cl-(aq),在25 ℃时,氯化银的Ksp=1.8×10-10。现将足量氯化银分别放入:①100 mL 蒸馏水中;②100 mL 0.2 mol·L-1 AgNO3溶液中;③100 mL 0.1 mol·L-1氯化铝溶液中;④100 mL 0.1 mol·L-1盐酸溶液中,充分搅拌后,相同温度下银离子浓度由大到小的顺序是________(填写序号);②中氯离子的浓度为___mol·L-1。
Ag+(aq)+Cl-(aq),在25 ℃时,氯化银的Ksp=1.8×10-10。现将足量氯化银分别放入:①100 mL 蒸馏水中;②100 mL 0.2 mol·L-1 AgNO3溶液中;③100 mL 0.1 mol·L-1氯化铝溶液中;④100 mL 0.1 mol·L-1盐酸溶液中,充分搅拌后,相同温度下银离子浓度由大到小的顺序是________(填写序号);②中氯离子的浓度为___mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,浓度均为1 mol·L-1的两种气体X2和Y2,在密闭容器中发生可逆反应生成气体Z。充分反应后,X2的浓度为0.4 mol·L-1,Y2的浓度为0.8 mol·L-1,生成气体Z的浓度为0.4 mol·L-1。则该反应的化学方程式(Z用X、Y表示)是( )
A.X2(g)+2Y2(g) ![]() 2XY2(g)
2XY2(g)
B.2X2(g)+Y2(g) ![]() 2X2Y(g)
2X2Y(g)
C.X2(g)+3Y2(g) ![]() 2XY3(g)
2XY3(g)
D.3X2(g)+Y2(g) ![]() 2X3Y(g)
2X3Y(g)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上通常利用SiO2 和碳反应来制取硅,写出反应的化学方程式___________________。
工业上还可以利用镁制取硅,反应为2Mg+SiO2 = 2MgO+Si,同时会发生副反应:2Mg + Si = Mg2Si。如图是进行Mg与SiO2反应的实验装置,试回答下列问题:

(1)由于O2和H2O(g)的存在对该实验有较大影响,实验中应通入气体X作为保护气,试管中的固体药品可选用________(填序号)。
a.石灰石 b.锌粒 c.纯碱
(2)实验开始时,必须先通一段时间X气体,再加热反应物,其理由是 ___________________________;当反应引发后,移走酒精灯,反应能继续进行,其原因是______________________。
(3)反应结束后,待冷却至常温时,往反应后的混合物中加入稀盐酸,可观察到闪亮的火星,产生此现象的原因是副产物Mg2Si遇盐酸迅速反应生成SiH4(硅烷)气体,然后SiH4自燃.用化学方程式表示这两个反应①________________________②___________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z为短周期元素,X的最外层电子数是Y原子最外层电子数的2倍,Y的原子序数比X的原子序数多5,Z原子的最外层电子数比Y多3。下列叙述正确的是( )
A.原子半径的大小顺序:Y>Z>X
B.Z单质与X单质直接反应可生成两种化合物
C.工业上,电解X和Y形成的化合物制取Y单质
D.Y、Z元素的最高价氧化物的水化物不能互相反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,向10mL pH=11的NH3·H2O溶液中加入下列物质,对所得溶液的分析正确的是( )
加入的物质 | 对所得溶液的分析 | |
A. | 90mL H2O | 由水电离出的c(H+)=10-10mol·L-1 |
B. | 0.1mol NH4Cl固体 | c(H+)比原NH3·H2O溶液中的大 |
C. | 10mL pH=13的NaOH溶液 | NH3·H2O的电离程度不变 |
D. | 10mL pH=3的盐酸 | 溶液呈中性 |
A.AB.BC.CD.D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com