
(14分)甲醇是重要的化工原料,在工业生产上的应用十分广泛。
(1)利用太阳能或生物质能分解水制H2,然后可将H2与CO2转化为甲醇。已知:
光催化制氢:2H2O(l)===2H2(g)+O2(g) ΔH=+571.5 kJ/mol ①
H2与CO2耦合反应:3H2(g)+CO2(g)===CH3OH(l)+H2O(l) ΔH=-137.8 kJ/mol ②
则反应:2H2O(l)+CO2(g) = CH3OH(l)+3/2O2(g)的ΔH= kJ/mol。
你认为该方法需要解决的技术问题有 (填字母)。
a. 开发高效光催化剂
b. 将光催化制取的H2从反应体系中有效分离,并与CO2耦合催化转化
c. 二氧化碳及水资源的来源供应
(2)工业上由甲醇制取甲醛的两种方法如下(有关数据均为在298 K时测定):
反应I:CH3OH(g)=HCHO(g)+H2(g) ΔH1=+92.09kJ/mol,K1=3.92×10-11。
反应II:CH3OH(g)+1/2O2(g)=HCHO(g)+H2O(g) ΔH2=-149.73 kJ/mol,K2=4.35×1029。
①从原子利用率看,反应 (填“I”或“II”。下同)制甲醛的原子利用率更高。从反应的焓变和平衡常数K值看,反应 制甲醛更有利。
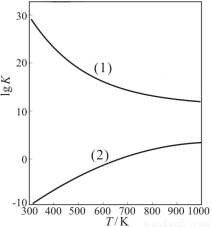
②下图是甲醇制甲醛有关反应的lgK(平衡常数的对数值)随温度T的变化。图中曲线(1)表示的是反应 。
(3)污水中的含氮化合物,通常先用生物膜脱氮工艺进行处理,在硝化细菌的作用下将NH4+氧化为NO3-(2NH4++3O2=2HNO2+2H2O +2H+;2HNO2 +O2=2HNO3)。然后加入甲醇,甲醇和NO3-反应转化为两种无毒气体。
①上述方法中,1 g铵态氮元素转化为硝态氮元素时需氧的质量为 g。
②写出加入甲醇后反应的离子方程式: 。
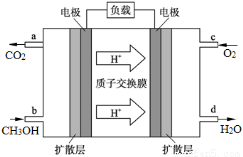
(4)甲醇燃料电池的工作原理如图所示,则该电池负极的电极反应式为 。
共14分。每空2分。
(1)-719.5(2分) ab(2分)
(2)①I(1分) II(1分) ②II(2分)
(3)①4.57(2分)
②6NO3-+5CH3OH+6H+=3N2↑+5CO2↑+13H2O(2分)
(4)CH3OH+H2O–6e-=CO2↑+6H+(2分)
【解析】
试题分析:(1)由盖斯定律得2H2O(l)+CO2(g) = CH3OH(l)+3/2O2(g)的ΔH=(①×3+②×2)/2,将①②的代入上式中得所求ΔH=-719.45kJ/mol;利用太阳能或生物质能分解水制H2,需要开发高效光催化剂,使水易在太阳光的作用下分解,同时将光催化制取的H2从反应体系中有效分离,并与CO2耦合催化转化,但二氧化碳及水资源的来源供应不是需要解决的技术问题,答案选ab;
(2)反应物中的原子尽可能的转化为生成物,原子的利用率越高,所以反应I的原子利用率高;反应II的化学平衡常数较大,说明反应进行的彻底程度较大,而且反应II是放热反应,所以从反应的焓变和平衡常数K值看,反应II制甲醛有利;
(3)①根据所给方程式可知2NH4+~4O2~2HNO3,1 g铵态氮元素转化为硝态氮元素时需氧的质量为2×32/14=4.57g,
②甲醇和NO3-反应转化为两种无毒气体,从元素守恒角度判断无毒气体是氮气和二氧化碳,另一种产物是水,离子方程式为6NO3-+5CH3OH+6H+=3N2↑+5CO2↑+13H2O
(4)燃料电池中燃料在电池的负极发生氧化反应,结合图中信息,甲醇被氧化为二氧化碳和氢离子,所以该电池的负极反应式为CH3OH+H2O–6e-=CO2↑+6H+
考点:考查盖斯定律的应用,化学平衡常数的应用,关系式法的应用,原电池电极反应式的书写


科目:高中化学 来源:2013-2014江苏省无锡市高一下学期期末考试化学试卷(解析版) 题型:选择题
下列装置或操作能达到实验目的的是
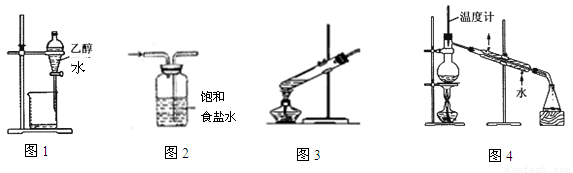
A.分离乙醇和水 B.除去氯气中的氯化氢 C.葡萄糖的银镜反应 D.石油的蒸馏
查看答案和解析>>
科目:高中化学 来源:2013-2014江苏省高二下学期阶段测试5月 化学试卷(解析版) 题型:选择题
要使金属晶体熔化必须破坏其中的金属键。金属晶体熔、沸点高低和硬度大小一般取决于金属键的强弱。由此判断下列说法正确的是
A.金属镁的熔点高于金属铝
B.碱金属单质的熔、沸点从Li到Cs是逐渐升高的
C.金属镁的硬度小于金属钙
D.金属铝的硬度大于金属钠
查看答案和解析>>
科目:高中化学 来源:2013-2014江苏省高三模拟考试化学试卷(解析版) 题型:选择题
下列说法正确的是
A.镀锌铁板是利用了牺牲阳极的阴极保护法来达到防止腐蚀的目的
B.在滴有酚酞的Na2CO3溶液中,加入BaCl2溶液后红色褪去,说明BaCl2溶液显酸性
C.合成氨反应需使用催化剂,说明催化剂可以促进该平衡向生成氨的方向移动
D.汽车尾气的净化反应2NO+2CO 2CO2+N2 △H<0,则该反应一定能自发进行
2CO2+N2 △H<0,则该反应一定能自发进行
查看答案和解析>>
科目:高中化学 来源:2013-2014江苏省高三模拟考试化学试卷(解析版) 题型:选择题
下列装置或操作不能实现实验目的的是
|
|
|
|
A.吸收易溶于水的气体 | B. 实验室制取氨气 | C.配制银氨溶液 | D.实验室制乙烯 |
查看答案和解析>>
科目:高中化学 来源:2013-2014江苏省徐州市高三考前模拟化学试卷(解析版) 题型:选择题
在一个容积为2 L的恒容密闭容器中加入0.2 mol CO和0.4 mol H2,发生反应:
CO(g)+2H2(g) CH3OH(g)
CH3OH(g)
实验测得在300℃和500℃时,甲醇的物质的量(mol)随时间的变化如下表所示。
| 10 min | 20 min | 30 min | 40 min | 50 min | 60 min |
300℃ | 0.080 | 0.120 | 0.150 | 0.168 | 0.180 | 0.180 |
500℃ | 0.120 | 0.150 | 0.156 | 0.160 | 0.160 | 0.160 |
下列说法正确的是
A.该反应的ΔH>0,升高温度,化学平衡常数K增大
B.300℃时,前20 min内的反应速率v(H2)=0.003 mol·L-1·min-1
C.采取加压、增大c(H2)、加入合适的催化剂等措施都能提高CO的转化率
D.500℃时,在起始时向容器中加入0.1 mol CO和0.3 mol H2,可计算出反应达平衡后甲醇的浓度
查看答案和解析>>
科目:高中化学 来源:2013-2014江苏省徐州市高三考前模拟化学试卷(解析版) 题型:选择题
下列表示对应化学反应的离子方程式正确的是
A.MnO2固体与浓盐酸反应制取Cl2:MnO2+4HCl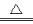 Mn2++2Cl-+Cl2↑+2H2O
Mn2++2Cl-+Cl2↑+2H2O
B.AlCl3溶液中滴加浓氨水至过量:Al3++4NH3·H2O=AlO2-+4NH4++2H2O
C.氯化亚铁溶液中加入硝酸:3Fe2++4H++NO3-=3Fe3++2H2O+NO↑
D.NH4HCO3溶于过量的NaOH溶液中:HCO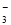 +OH-===CO
+OH-===CO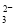 +H2O
+H2O
查看答案和解析>>
科目:高中化学 来源:2013-2014江苏省徐州市高三第三次模拟考试化学试卷(解析版) 题型:选择题
只用下表提供的仪器、试剂,就能达到相应实验目的的是( )
选项 | 仪器 | 试剂 | 相应实验目的 |
A | 托盘天平(带砝码)、滴管、量筒、烧杯、药匙、玻璃棒 | 食盐,蒸馏水 | 配制一定物质的量浓度的NaCl溶液 |
B | 烧杯、漏斗、滴管、铁架台(带铁圈)、玻璃棒、滤纸、导气管 | AlCl3溶液(含少量MgCl2),烧碱,CO2,稀盐酸 | 除去AlCl3溶液中少量的MgCl2 |
C | 酸式滴定管、滴管、铁架台(带铁夹) | 已知浓度的盐酸,未知浓度的NaOH溶液 | 测定NaOH溶液的浓度 |
D | 分液漏斗、烧瓶、锥形瓶、导管、橡皮塞 | 稀盐酸,大理石,硅酸钠溶液 | 证明非金属性:Cl>C>Si |
查看答案和解析>>
科目:高中化学 来源:2013-2014江苏省吴江市高二下学期期中考试化学试卷(解析版) 题型:选择题
下列事实能说明NH3·H2O一定是弱电解质的是
①常温下,NH3·H2O溶液能使酚酞变红; ②用NH3·H2O溶液做导电性实验,灯泡很暗;
③常温下,0.1mol / L氯化铵溶液的pH约为5
④常温下,体积相同且pH相同的NH3·H2O溶液和NaOH溶液,与相同浓度的HCl溶液中和时,消耗HCl溶液的体积:前者>后者
A.①②③④ B.②③④ C.③④ D.②④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com