
| A. | 实验证实,不存在两种邻二甲苯,所以现代物质结构理论认为苯分子中碳碳键完全相同,而不是单双键交替结构 | |
| B. | 两种有机物若具有相同的摩尔质量,不同的结构,则一定是互为同分异构体 | |
| C. | 醛能发生银镜反应,但发生银镜反应的有机物不一定是醛类 | |
| D. | 等质量的两种有机物完全燃烧生成等质量的水,则两有机物中氢元素的质量分数必须是相等 |
分析 A.若苯的结构中存在单、双键交替结构,邻二甲苯的邻位二元取代物有两种;
B.具有相同的摩尔质量,但分子式不一定相同;
C.含有醛基的有机物都可发生银镜反应;
D.含氢量相等时,等质量的有机物燃烧生成等质量的水.
解答 解:A.若苯的结构中存在单、双键交替结构,邻二甲苯的邻位二元取代物有两种,若碳碳键都完全相同时,邻二甲苯仅有一种,故A正确;
B.具有相同的相对分子质量,分子式可能不同,如乙酸C2H4O2和丙醇C3H8O,故B错误;
C.含有醛基的有机物都可发生银镜反应,葡萄糖、甲醛、甲酸等都含有醛基,都可发生银镜反应,故C正确;
D.含氢量相等时,等质量的有机物燃烧生成等质量的水,故D正确.
故选B.
点评 本题考查有机物的结构与性质,为高频考点,把握结构、官能团与性质、有机反应为解答关键,侧重分析与应用能力的考查,难度不大.


 孟建平名校考卷系列答案
孟建平名校考卷系列答案科目:高中化学 来源: 题型:解答题
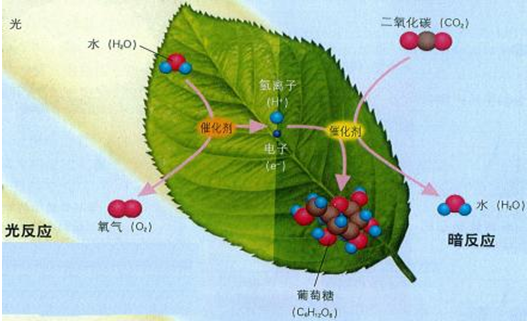
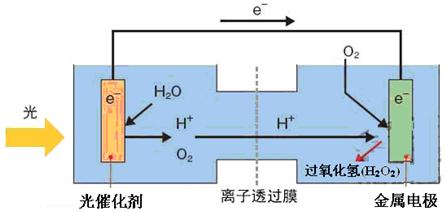
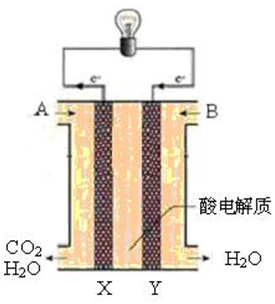
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 ②
②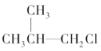 ③(CH3)3C-CH2Cl ④CHCl2-CHBr2 ⑤
③(CH3)3C-CH2Cl ④CHCl2-CHBr2 ⑤ ⑥CH3Cl.
⑥CH3Cl.| A. | ①③⑥ | B. | ②③⑤ | C. | ②③ | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
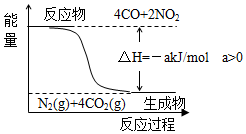 研究NOx、SO2、CO等大气污染气体的处理方法具有重要意义.
研究NOx、SO2、CO等大气污染气体的处理方法具有重要意义.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加热条件下,20mL10mol/L浓硝酸与足量铜反应转移电子数为0.1NA | |
| B. | 78gNa2O2固体中含有的阴离子数目为2NA | |
| C. | 标准状况下,11.2 L由CH4和C2H4组成的混合气体中含有氢原子的数目为2 NA | |
| D. | 常温下,4gCH4中含有4NA个C-H共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.6g甲烷含有的电子数为NA | |
| B. | 1L0.1mol•L-1NaHCO3溶液中含有的HCO3-数目为0.1NA | |
| C. | 1LpH=1的硫酸溶液中含有的H+数为0.2NA | |
| D. | 标准状况下,2.24LCO和CO2混合气体中含有的氧原子数为0.15NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 简单立方堆积的晶胞中原子配位数是8 | |
| B. | 晶胞中配位数为12的金属,一定是面心立方最密堆积 | |
| C. | Zn的晶胞类型与铜相同 | |
| D. | 铁的晶胞中空间利用率为74% |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com