
| A. | NH4Cl | B. | NaCl | C. | KCl | D. | BaCl2 |
分析 蛋白质在某些条件下能变性,这是一种不可逆的化学变化,使蛋白质变性的条件有多种,如强酸、强碱、可溶性重金属盐、甲醛、加热等.
解答 解:蛋白质遇到可溶性非重金属盐,蛋白质溶液会因溶解度降低而从溶液中析出,氯化钠和氯化铵、氯化钾可以,盐析是可逆的,加水后沉淀又会溶解.
蛋白质在某些条件下能变性,这是一种不可逆的化学变化,使蛋白质变性的条件有多种,如强酸、强碱、可溶性重金属盐(乙酸铅)、甲醛、丙酮、加热等,CuSO4、H2SO4、酒精能使蛋白质发生变性,氯化钡属于重金属盐,会使蛋白质变性,加入鸡蛋清中,出现白色沉淀,加水沉淀不会溶解.
故选D.
点评 本题考查蛋白质的性质,题目难度不大,本题中注意能使蛋白质盐析的盐类.


科目:高中化学 来源: 题型:多选题
| A. | 少量SO2通入Ca(ClO)2溶液中:SO2+H2O+Ca2++2ClO-═CaSO3↓+2HClO | |
| B. | 在稀氨水中通入少量CO2:2NH3•H2O+CO2═2NH4++CO32-+H2O | |
| C. | 用稀HCl溶液溶解FeS固体:FeS+2H+═Fe2++H2S↑ | |
| D. | Cl2与水反应:Cl2+H2O═HCl+HClO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 澄清石灰水与少量小苏打溶液混合:Ca2++2OH-+2HCO3-═CaCO3↓+CO32-+2H2O | |
| B. | 氯化铝溶液中加入过量的氨水:Al3++4NH3•H2O═Al(OH)4-+4NH4+ | |
| C. | 少量CO2通入苯酚钠溶液中:2C6H5O-+CO2+H2O═2C6H5OH+CO32- | |
| D. | 向NH4HSO4稀溶液中逐滴加入Ba(OH)2稀溶液至SO42-刚好沉淀完全:Ba2++2OH-+NH4++H++SO42-═BaSO4↓+NH3•H2O+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
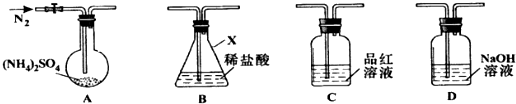
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
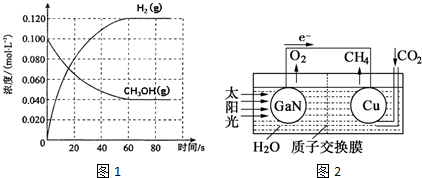
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③⑤⑥ | B. | ①②③⑤ | C. | ①②⑤ | D. | ①②④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过氧乙酸与羟基乙酸(HOCH2COOH)互为同系物 | |
| B. | 过氧乙酸与苯酚混合使用杀菌能力更强 | |
| C. | 过氧乙酸因具有强氧化性,所以有杀菌作用 | |
| D. | 在使用过氧乙酸消毒时浓度越大越好 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com