
NA表示阿伏加德罗常数的值,下列叙述正确的是( )
A.标准状况下,11.2 L四氯化碳中C—Cl键的数目为2.0NA
B.常温下,1 L 0.1 mol/L NH4NO3溶液中的氮原子数为0.2NA
C.在反应:H2O2+Cl2 2HCl+O2中,每生成32 g氧气,转移的电子数
2HCl+O2中,每生成32 g氧气,转移的电子数
为4NA
D.22.4 L由CO和C2H4组成的混合气体的质量一定为28 g
科目:高中化学 来源:2014高考化学专题突破训练 专题8电化学原理练习卷(解析版) 题型:选择题
用酸性氢氧燃料电池为电源进行电解的实验装置图如图所示,下列说法中正确的是( )
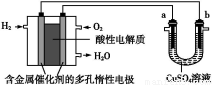
A.燃料电池工作时,正极反应为:O2+2H2O+4e-=4OH-
B.a极是铁,b极是铜时,b极逐渐溶解,a极上有铜析出
C.a极是粗铜,b极是纯铜时,a极逐渐溶解,b极上有铜析出
D.a、b两极均是石墨时,在相同条件下a极产生的气体与电池中消耗的H2体积相等
查看答案和解析>>
科目:高中化学 来源:2014高考化学专题突破训练 专题4化学反应中的能量变化练习卷(解析版) 题型:填空题
(1)新的《环境空气质量标准》(GB 3095 2012)将于2016年1月1日在我国全面实施。据此,环境空气质量指数(AQI)日报和实时报告包括了SO2、NO2、CO、O3、PM10、PM2.5等指标,为公众提供健康指引,引导当地居民合理安排出行和生活。
2012)将于2016年1月1日在我国全面实施。据此,环境空气质量指数(AQI)日报和实时报告包括了SO2、NO2、CO、O3、PM10、PM2.5等指标,为公众提供健康指引,引导当地居民合理安排出行和生活。
①汽车排出的尾气中含有CO和NO等气体,用化学方程式解释产生NO的原因 。
②汽车排气管内安装的催化转化器,可使汽车尾气中的主要污染物转化为无毒的大气循环物质。已知:
N2(g)+O2(g)=2NO(g) ΔH=+180.5 kJ/mol
2C(s)+O2(g)=2CO(g) ΔH=-221.0 kJ/mol
C(s)+O2(g)=CO2(g) ΔH=-393.5 kJ/mol
则反应2NO(g)+2CO(g)=N2(g)+2CO2(g)的ΔH= kJ/mol。
(2)直接排放氮氧化物会形成酸雨、雾霾,催化还原法和氧化吸收法是常用的处理方法。利用NH3和CH4等气体除去烟气中的氮氧化物。已知:CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH1=a kJ/mol;欲计算反应CH4(g)+4NO(g)=CO2(g)+2H2O(l)+2N2(g)的焓变ΔH2则还需要查询某反应的焓变ΔH3,当反应中各物质的化学计量数之比为最简整数比时,ΔH3=b kJ/mol,该反应的热化学方程式是 ,据此计算出ΔH2= kJ/mol(用含a、b的式子表示)。
(3)下表列出了工业上吸收SO2的三种方法。
方法Ⅰ | 用氨水将SO2转化(NH4)2SO3,再氧化成(NH4)2SO4 |
方法Ⅱ | 用生物质热解气(主要成分CO、CH4、H2)将SO2在高温下还原成单质硫 |
方法Ⅲ | 用Na2SO3溶液吸收SO2,再经电解转化为H2SO4 |
方法Ⅱ主要发生了下列反应:
2CO(g)+SO2(g)=S(g)+2CO2(g) ΔH=+8.0 kJ/mol
2H2(g)+SO2(g)=S(g)+2H2O(g)ΔH=+90.4 kJ/mol
2CO(g)+O2(g)=2CO2(g) ΔH=-566.0 kJ/mol
2H2(g)+O2(g)=2H2O(g) ΔH=-483.6 kJ/mol
则S(g)与O2(g)反应生成SO2(g)的热化学方程式可表示为 。
(4)合成氨用的氢气可以甲烷为原料制得。有关化学反应的能量变化如图所示,则CH4(g)与H2O(g)反应生成CO(g)和H2(g)的热化学方程式为 。

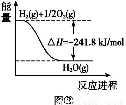
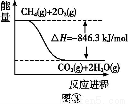
查看答案和解析>>
科目:高中化学 来源:2014高考化学专题突破训练 专题3氧化还原反应 离子反应练习卷(解析版) 题型:选择题
在熔融KOH中,大气中的氧可将铬铁矿(FeCr2O4)中Fe和Cr的化合价都转化为+6价,氧化1 mol FeCr2O4在理论上需要氧气( )
A.2 mol B.2.5 mol C.3 mol D.4 mol
查看答案和解析>>
科目:高中化学 来源:2014高考化学专题突破训练 专题2化学常用计量 溶液练习卷(解析版) 题型:选择题
在200 mL某硫酸盐溶液中含有1.5NA个硫酸根离子(NA表示阿伏加德罗常数的值),同时含有NA个金属阳离子,则该硫酸盐的物质的量浓度为( )
A.1 mol/L B.2.5 mol/L C.5 mol/L D.2 mol/L
查看答案和解析>>
科目:高中化学 来源:2014高考化学专题突破训练 专题1物质的组成性质分类和化学用语练习卷(解析版) 题型:选择题
化合物A、B、C、D各由两种元素组成,甲、乙、丙是前两周期元素的三种单质。这些常见的化合物与单质之间存在如下关系(已知C是一种有机物),以下结论不正确的是( )

A.甲、乙、丙三种单质均为气态非金属单质
B.上述转化关系所涉及的化合物中有一种是电解质
C.上图所示的五个转化关系中,有三个是化合反应
D.上图所示的五个转化关系中,均为氧化还原反应
查看答案和解析>>
科目:高中化学 来源:2014高考化学专题突破训练 专题1物质的组成性质分类和化学用语练习卷(解析版) 题型:选择题
下列化学用语中,书写错误的是( )
A.硫离子的结构示意图:
B.氟化钠的电子式:Na+[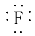 ]-
]-
C.甲基的电子式: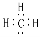
D.次氯酸的结构式:H—O—Cl
查看答案和解析>>
科目:高中化学 来源:2014高考化学专题突破训练 专题13物质结构与性质选修3练习卷(解析版) 题型:填空题
一水硫酸四氨合铜(Ⅱ)([Cu(NH3)4]SO4·H2O)是一种重要的染料及农药中间体。请回答下列相关问题:
(1)Cu的核外电子排布式为 。
(2)N的L层中有 对成对电子;N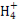 立体构型是 ,其中心原子的杂化方式为 。
立体构型是 ,其中心原子的杂化方式为 。
(3)氨水溶液中存在多种氢键,任表示出其中两种 ;
(4)[Cu(NH3)4]SO4·H2O中呈深蓝色的离子是 ,该微粒中的“电子对给予一接受键”属于 键;
(5)Cu的一种氯化物晶胞结构如图所示,该氯化物的化学式 。
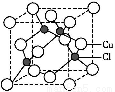
查看答案和解析>>
科目:高中化学 来源:2014江苏省扬州市届高三上学期期末考试化学试卷(解析版) 题型:填空题
由软锰矿制备高锰酸钾的主要反应如下:
熔融氧化 3MnO2+KClO3+6KOH 3K2MnO4+KCl+3H2O
3K2MnO4+KCl+3H2O
加酸歧化 3K2MnO4+2CO2=2KMnO4+MnO2↓+2K2CO3
相关物质的溶解度(293K)见下表:
| K2CO3 | KHCO3 | K2SO4 | KMnO4 |
溶解度/g | 111 | 33.7 | 11.1 | 6.34 |
(1)在实验室进行“熔融氧化”操作时,应选用铁棒、坩埚钳和 。(填字母)
a.表面皿 b.蒸发皿 c.铁坩埚 d.泥三角
(2)加酸时不宜用硫酸的原因是 ;不宜用盐酸的原因是 。
(3)采用电解法也可以实现K2MnO4的转化,2K2MnO4+2H2O 2KMnO4+2KOH+H2↑。与原方法相比,电解法的优势为 。
2KMnO4+2KOH+H2↑。与原方法相比,电解法的优势为 。
(4)草酸钠滴定法分析高锰酸钾纯度步骤如下:
Ⅰ 称取0.80 g 左右的高锰酸钾产品,配成50 mL溶液。
Ⅱ 准确称取0.2014 g左右已烘干的Na2C2O4,置于锥形瓶中,加入少量蒸馏水使其溶解,再加入少量硫酸酸化。
Ⅲ 将瓶中溶液加热到75~80 ℃,趁热用Ⅰ中配制的高锰酸钾溶液滴定至终点。记录消耗高锰酸钾溶液的体积,计算得出产品纯度。
①滴定过程中反应的离子方程式为 。
②达到滴定终点的标志为 。
③加热温度大于90℃,部分草酸发生分解,会导致测得产品纯度 。(填“偏高”、“偏低”或“无影响”)
④将一定量高锰酸钾溶液与酸化的草酸钠溶液混合,测得反应液中Mn2+的浓度随反应时间t的变化如图,其原因可能为 。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com