
| A. | 所得溶液中C(Fe2+):C(Fe3+)=1:1 | B. | 所得溶液中C(NO3-)=2.75mol/L | ||
| C. | 反应后生成NO的体积为28 L | D. | 所得溶液中溶质只有FeSO4和K2SO4 |
分析 n(H+)=2.5mol×2=5mol,n(NO3-)=4mol,发生3Fe+2NO3-+8H+=3Fe2++2NO↑+4H2O或Fe+NO3-+4H+=Fe3++NO↑+2H2O,铁粉的物质的量为1.5mol,由离子方程式判断过量,然后设出未知数,结合反应列式计算即可.
解答 解:溶液中氢离子总物质的量为:n(H+)=2.5mol×2=5mol,n(NO3-)=4mol,铁粉的物质的量为1.5mol,
由 3Fe+2NO3-+8H+=3Fe2++2NO↑+4H2O,
3 2 8
1.5mol 1mol 4mol,
则1.5molFe完全反应时,硝酸根离子与氢离子均过量,
则发生Fe+NO3-+4H+=Fe3++NO↑+2H2O,
若1.5molFe完全反应时,氢离子不足,则两个反应均发生,
Fe+NO3-+4H+=Fe3++NO↑+2H2O
x 4x x x
3Fe+2NO3-+8H+=3Fe2++2NO↑+4H2O
y $\frac{8}{3}$y y $\frac{2}{3}$y
则:x+y=1.5、4x+$\frac{8}{3}$y=5,
解得:x=0.75mol,y=0.75mol
生成NO的体积为(0.75mol+0.75mol×$\frac{2}{3}$)×22.4L/mol=28L,
A.反应后生成铁离子为0.75mol,亚铁离子为0.75mol,c(Fe2+):c(Fe3+)=n(Fe2+):n(Fe3+)=1:1,故A正确;
B.反应消耗硝酸根离子等于生成NO的量=0.75mol+0.75mol×$\frac{2}{3}$=1.25mol,缺少溶液体积,无法计算溶液中硝酸根离子浓度,故B错误;
C.根据分析可知,反应后生成标况下28LNO,不是标况下,NO气体不一定为28L,故C错误;
D.反应后中含有硫酸铁和硫酸亚铁,故D错误;
故选A.
点评 本题考查氧化还原反应的计算,为高频考点,题目难度中等,把握反应中电子守恒为解答的关键,注意过量判断及发生的反应判断,侧重分析与计算能力的考查;B、C为易错点,注意C不是标况下、B缺少溶液体积,试题培养了学生的化学计算能力.


科目:高中化学 来源: 题型:选择题
| A. | Cl2与H2O反应:Cl2+H2O═2H++ClO-+Cl- | |
| B. | 往FeCl3溶液中加入Cu粉:Fe3++Cu═Fe2++Cu2+ | |
| C. | 向AlCl3溶液中滴加氨水至过量:Al3++3OH-═Al(OH)3↓ | |
| D. | 将铜片投入浓硝酸中:2NO3-+Cu+4H+═Cu2++2NO2↑+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
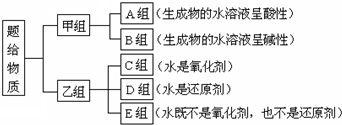
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 日常生活中的陶瓷、水泥、玻璃等是使用量最大的无机非金属材料 | |
| B. | 制饭勺、高压锅等的不锈钢是合金.合金有许多优良的性能,如熔点比成分金属高 | |
| C. | 防止或减少雾霾形成的措施之一是减少煤的燃烧和机动车的使用 | |
| D. | 食品干燥剂应无毒、无味、无腐蚀性及环境友好,硅胶可用作食品干燥剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 生成0.1 mol O2转移0.4mol电子 | |
| B. | 相同条件下足量Na2O2吸收10LCO2放出5LCO2 | |
| C. | 氧化剂是Na2O2,还原剂是CO2 | |
| D. | 在Na2O2+SO2═Na2SO4的反应中,SO2的作用跟CO2相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
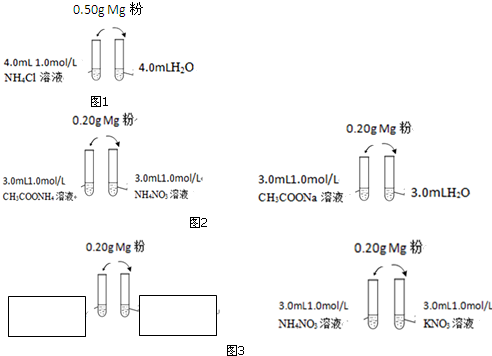
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ba2+、K+、Na+、SO42- | B. | Na+、H+、OH-、Cl- | ||
| C. | Mg2+、K+、Cl-、NO3- | D. | Ca2+、K+、CO32-、SO42- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com