
| A. | 1 mol H2SO4的质量为98g•mol-1 | |
| B. | H2SO4的摩尔质量为98g | |
| C. | 9.8 g H2SO4含有NA个H2SO4分子 | |
| D. | 6.02×1022个H2SO4分子的质量为9.8g |
分析 A.质量的单位为g;
B.摩尔质量的单位为g•mol-1;
C.根据N=nNA=$\frac{m}{M}$×NA计算;
D.根据m=nM=$\frac{N}{{N}_{A}}$×M计算.
解答 解:A.1mol H2SO4的质量为98g,故A错误;
B.H2SO4的相对分子质量为98,H2SO4的摩尔质量为98g•mol-1,故B错误;
C.9.8 g H2SO4含有H2SO4分子N=nNA=$\frac{m}{M}$×NA=$\frac{9.8g}{98g/mol}$×NA=0.1NA,故C错误;
D.6.02×1022个H2SO4分子的质量为m=nM=$\frac{N}{{N}_{A}}$×M=$\frac{6.02×1{0}^{22}}{6.02×1{0}^{23}}$mol×98g/mol=9.8g,故D正确;
故选D.
点评 本题考查物质的量的有关计算,题目难度不大,计算时须注意把握有关计算公式的灵活运用.


 教材全解字词句篇系列答案
教材全解字词句篇系列答案科目:高中化学 来源: 题型:选择题
| A. | 在碱金属元素中,所有碱金属的氧化物均属于碱性氧化物 | |
| B. | 由于活泼性Na<K,故金属钾可以从NaCl 溶液中置换出钠单质 | |
| C. | 金属锂不能保存在煤油中,金属钾可以保存在煤油中 | |
| D. | 碱金属在自然界中都以游离态存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
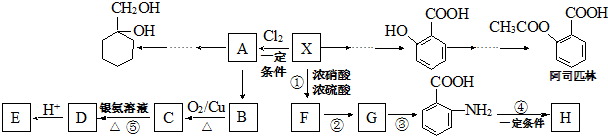
 (苯胺,易被氧化)
(苯胺,易被氧化) .
. 的同系物M比其本身相对分子质量大14,M的同分异构体中能同时满足以下条件:①芳香族化合物,②能发生水解反应,③与FeCl3溶液能够发生显色反应;共有19(不考虑立体异构)种.
的同系物M比其本身相对分子质量大14,M的同分异构体中能同时满足以下条件:①芳香族化合物,②能发生水解反应,③与FeCl3溶液能够发生显色反应;共有19(不考虑立体异构)种.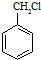 和其他无机物合成
和其他无机物合成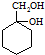 最合理的方案.
最合理的方案. .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| n(SO32-):n(HSO3-) | 91:9 | 1:1 | 1:91 |
| PH | 8.2 | 7.2 | 6.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ;比较C和D的稳定性的强弱大小H2O>NH3(用化学式表示)
;比较C和D的稳定性的强弱大小H2O>NH3(用化学式表示)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5 | B. | 4 | C. | 3 | D. | 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 燃料电池的A极连接电解池的C极 | |
| B. | 燃料电池工作时当0.2 NA个H+通过质子交换膜移向右边,饱和食盐水中可产生2.24L气体 | |
| C. | A电极的电极反应式为:CH4-8e-+2H2O═CO2+8H+ | |
| D. | 电解池总反应式为NaCl+H2O$\frac{\underline{\;电解\;}}{\;}$NaClO+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com