
| 实验序号 | H2C2O4溶液 | KMnO4溶液 | 温度 |
| Ⅰ | 20mL 0.2mol•L-1 | 30mL 0.01mol•L-1 | 25℃ |
| Ⅱ | 20mL 0.1mol•L-1 | 30mL 0.01mol•L-1 | 25℃ |
| Ⅲ | 20mL 0.2mol•L-1 | 30mL 0.01mol•L-1 | 50℃ |
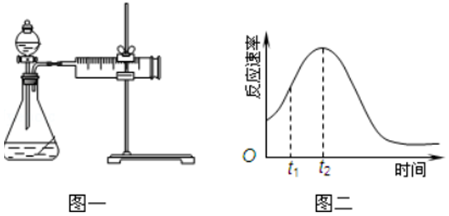
分析 (1)KMnO4和H2C2O4发生氧化还原反应生成锰离子、二氧化碳、水,根据得失电子守恒、电荷守恒配平离子方程式;高锰酸根为紫色,二价锰离子无色;
(2)对比Ⅰ、Ⅲ实验温度不同,其他条件相同;
(3)①该实验要收集气体,实验前必须检查气密性;反应速率越快,相同时间内收集到的二氧化碳越多;
②先求出反应的n(MnO4-)的物质的量,再求出反应后的浓度;
(4)根据反应过程中反应物浓度在减小,要加快反应的条件还可能是温度和催化剂的作用.
解答 解:(1)KMnO4和H2C2O4发生氧化还原反应生成锰离子、二氧化碳、水,KMnO4和中锰降低了5价,1个H2C2O4分子中有2个+3价的C,所以升高1×2=2价,根据化合价升降总数相等可以确定KMnO4和H2C2O4的比例关系为:2:5,再根据电荷守恒配平离子方程式:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O;反应现象为溶液紫色变浅(或溶液紫色褪去),有无色气泡产生,
故答案为:2;5H2C2O4;6H+;2;10;8;溶液紫色变浅(或溶液紫色褪去),有无色气泡产生;
(2)对比Ⅰ、Ⅲ实验可知温度不同,高锰酸钾溶液的浓度相同,草酸浓度也相同,则两个实验是探究温度对化学反应速率的影响,
故答案为:Ⅰ、Ⅲ;
(3)①该实验要收集气体,实验前必须检查气密性;Ⅱ中草酸的浓度比Ⅰ大,Ⅱ的化学反应速率大于Ⅰ,Ⅲ的温度最高,温度每升高10℃,反应速率增大2到4倍,所以Ⅲ的反应速率大于Ⅰ和Ⅱ,反应速率越快,相同时间内收集到的二氧化碳越多,则相同时间内所得CO2的体积由大到小的顺序是Ⅲ>Ⅰ>Ⅱ,
故答案为:检查装置气密性;Ⅲ>Ⅰ>Ⅱ;
②CO2的物质的量是:4.48×10-3L÷22.4L/mol=0.0002mol,设2min末,消耗n(MnO4-)为x
2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O
2 10
x 0.0002mol
解得x=0.00004mol
余下的n(MnO4-)=30×10-3L×0.01mol•L-1-0.00004mol=0.00026mol
则2min中末c(MnO4-)=$\frac{n}{V}$=$\frac{0.00026mol}{0.05L}$=0.0052mol/L
故答案为:0.0052;
(4)研究发现反应速率总是如图二所示发生变化,则t1~t2时间内速率变快的主要原因可能是:
①该反应为放热反应,反应放出的热量使环境温度升高,加快了反应速率,
②产物Mn2+(或MnSO4)是反应的催化剂,
故答案为:产物Mn2+(或MnSO4)是反应的催化剂.
点评 本题考查了影响化学反应速率的因素,注意掌握影响化学反应速率的因素,明确探究影响化学反应速率因素的方法,难度中等.


科目:高中化学 来源: 题型:选择题
| 容器 | 甲 | 乙 | 丙 |
| 反应物的投入量 | 3molA、2molB | 6molA、4molB | 2molC |
| 达到平衡的时间/min | 5 | 8 | |
| A的浓度/mol•L-1 | C1 | C2 | |
| C的体积分数/% | ω1 | ω3 | |
| 混合气体的密度/g•L-1 | ρ1 | ρ2 |
| A. | 若 x<4,2C1<C2 | |
| B. | 容器甲达到平衡所需的时间比容器乙达到平衡所需的时间短 | |
| C. | 无论x的值是多少,均有2ρ1=ρ2 | |
| D. | 若 x=4,则ω1=ω3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
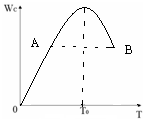 对于反应2A(g)+B(g)?2C(g)在反应过程中C的质量分WC随温度变化如图所示,试确定:
对于反应2A(g)+B(g)?2C(g)在反应过程中C的质量分WC随温度变化如图所示,试确定:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用托盘天平称量25.21 g氯化钠 | B. | 用10 mL量筒量取7.50 mL稀硫酸 | ||
| C. | 用25 mL滴定管量取14.86 mL溶液 | D. | 用广泛pH试纸测得溶液的pH为4.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com