现有密度为1.47g/mL 57%硫酸溶液,向其中加入质量分数与原硫酸相同的浓硝酸,混合成为27%硫酸和30%硝酸的混合酸.
计算(1)原硫酸的物质的量浓度为多少?
(2)形成混合酸所需原硫酸与加入的浓硝酸的质量比为多少?
解:(1)因ρ=1.47g/mL,质量分数为57%,
则原硫酸的物质的量浓度为

=8.55mol/L,
答:原硫酸的物质的量浓度为8.55mol/L;
(2)设原硫酸的质量为x,加入的浓硝酸的质量为y,
根据混合前后硫酸的质量不变,则
x×57%=(x+y)×27%,
解得x:y=9:10,
答:形成混合酸所需原硫酸与加入的浓硝酸的质量比为9:10.
分析:(1)已知密度为1.47g/mL、57%硫酸溶液,根据c=
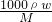
来计算原硫酸的物质的量浓度;
(2)根据硫酸的质量在混合前后不变来列等式计算.
点评:本题考查物质的量浓度的计算及溶液混合前后的计算,明确已知信息利用公式来计算及混合前后溶质的质量关系是解答本题的关键.

 =8.55mol/L,
=8.55mol/L,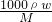 来计算原硫酸的物质的量浓度;
来计算原硫酸的物质的量浓度;
