
【题目】已知可逆反应:M(g)+N(g)![]() P(g)+Q(g) △H> 0请回答下列问题
P(g)+Q(g) △H> 0请回答下列问题
(1)在某温度下,反应物的起始浓度分别为c(M)=1mol/L,c(N)=2.4mol/L;达到平衡后,M的转化率为60%,此时N的转化率为____________
(2)若反应温度升高,M的转化率 (填“增大”、“减小”或“不变”)
(3)若反应温度不变,反应物的起始浓度分别为c(M)=4mol/L,c(N)=amol/L;达到平衡后,c(P)=2mol/L,a=____________
(4)若反应温度不变,反应物的起始浓度为c(M)=c(N)=bmol/L,达到平衡后,M的转化率为____________
【答案】(1)25%(2)增大(3)6(4)41%
【解析】
试题分析:(1)△c(M)=60%×1molL-1=0.6molL-1,浓度变化量之比等于化学计量数之比,所以△c(N)=△c(M)=0.6molL-1,此时N的转化率0.6mol/L÷2.4mol/L×100%=25%;
(2)该反应正反应为吸热反应,升高温度平衡向吸热方向移动,即向正反应方向移动,M的转化率增大;
(3))△c(M)=60%×1molL-1=0.6molL-1,则:
M(g)+N(g)![]() P(g)+Q(g);
P(g)+Q(g);
初始(mol/L):1 2.4 0 0
转化(mol/L):0.6 0.6 0.6 0.6
平衡(mol/L):0.4 1.8 0.6 0.6
该温度下平衡常数K=(0.6×0.6)÷(0.4×1.8) =0.5,反应温度不变,反应物的起始浓度分别为c(M)=4molL-1,c(N)=amolL-1;达到平衡后,c(P)=2molL-1,则:
M(g)+N(g)![]() P(g)+Q(g);
P(g)+Q(g);
初始(mol/L):4 a 0 0
转化(mol/L):2 2 2 2
平衡(mol/L):2 a-2 2 2
所以(2×2)÷[2×(a-2)] =0.5,解得a=6.
(4)设平衡时M的浓度变化量为为xmol/L,则:
M(g)+N(g)![]() P(g)+Q(g);
P(g)+Q(g);
初始(mol/L):b b 0 0
变化(mol/L):x x x x
平衡(mol/L):b-x b-x x x
所以(x×x)÷[(b-x)×(b-x) =0.5,解得x=0.41b,M的转化率为0.41b mol/L÷b mol/L×100%=41%.


科目:高中化学 来源: 题型:
【题目】海水是一个巨大的化学资源库,下列有关海水综合利用的说法错误的是
A.海水中含有溴元素,需经过化学变化才可以得到溴单质
B.无论是海水波浪发电还是潮汐发电,都是将化学能转化为电能
C.从海水中可以得到NaCl电解熔融NaCl可制备金属钠
D.从海水中提取镁可以采用下列方法:海水![]() Mg(OH)2
Mg(OH)2![]() MgCl2溶液→MgCl2→MgCl2(熔解)
MgCl2溶液→MgCl2→MgCl2(熔解)![]() Mg
Mg
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某物质R完全燃烧的化学方程式为:2R+3O2 ![]() 2CO2 + 4H2O 有关该反应,有下列说法:
2CO2 + 4H2O 有关该反应,有下列说法:
①R一定含碳、氢两种元素,可能含有氧元素
②R中碳元素的质量分数是37.5 %
③6.4g R完全燃烧,转移1.2NA个电子
④R的摩尔质量为32
若6.4 g R完全燃烧生成8.8 g CO2,则正确的一组是
A.① ② B. ③④ C.②④ D. ②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I、有A、B、C三种可溶性盐,阴、阳离子各不相同,其阴离子的摩尔质量按A、B、C的顺序依次增大。将等物质的量的A、B、C溶于水,所得溶液中只含有Fe3+、NH4+、SO![]() 、NO
、NO![]() 、Cl-五种离子,同时生成一种白色沉淀。请回答下列问题:
、Cl-五种离子,同时生成一种白色沉淀。请回答下列问题:
(1)经检验,三种盐中还含有下列选项中的一种离子,该离子是____________。
A. Na+ B.Ba2+ C.Mg2+ D. Cu2+
(2)写出C的化学式:C____________。
(3)若将A、B、C三种盐按一定比例溶于水,所得溶液中只含有Fe3+、Cl-、NO![]() 、NH4+四种离子且物质的量之比依次为1∶1∶3∶1(不考虑水电离的影响)。则A、B、C三种盐的物质的量之比为____________。若向B溶液中通入少量SO2气体,有沉淀和无色气体产生,该沉淀为 。
、NH4+四种离子且物质的量之比依次为1∶1∶3∶1(不考虑水电离的影响)。则A、B、C三种盐的物质的量之比为____________。若向B溶液中通入少量SO2气体,有沉淀和无色气体产生,该沉淀为 。
II、已知某KNO3溶液A中,混有少量的Ca2+和SO![]() 等杂质,某同学设计了如下实验方案以制得纯净的KNO3固体。
等杂质,某同学设计了如下实验方案以制得纯净的KNO3固体。

根据上述回答:
(1)沉淀D中所含有的物质是 。
(2)按上述实验方案制得的KNO3晶体,经分析测定仍含有杂质,其原因是上述第 步(填① ② ③)可能有误,请加以改正: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
I.化合物Mg5Al3(OH)19(H2O)4可作环保型阻燃材料,受热时按如下化学方程式分解:
2Mg5Al3(OH)19(H2O)4![]() 27H2O↑+10MgO+3A12O3
27H2O↑+10MgO+3A12O3
(1)写出该化合物作阻燃剂的两条依据____________________________________。
(2)用离子方程式表示除去固体产物中A12O3的原理________________________。
II.以冶铝的废弃物铝灰为原料制取超细α-氧化铝,既降低环境污染又可提高铝资源的利用率。已知铝灰的主要成分为A12O3(含少量杂质SiO2、FeO、Fe2O3),其制备实验流程如下:
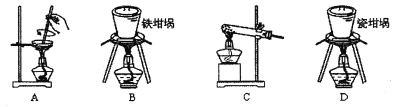
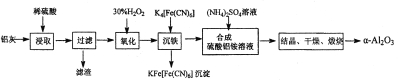
(1)用图中“滤渣”和NaOH焙烧制备硅酸钠,可采用的装置为_______(填选项编号)。
(2)验证“沉铁”后,溶液中是否还含有铁离子的操作方法为____________________。
(3)若用调节溶液的pH“沉铁”,则得到Fe(OH)3,己知:
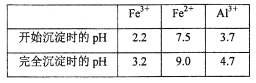
为保证产品的纯度,最好选用下列物质中的_______调节pH(填字母),调节pH的范围为_____。
a.A12O3
B.H2SO4
C.NaOH
D.Na2CO3
(4)煅烧硫酸铝铵晶体,发生的主要反应为:
4[NH4Al(SO4)2·12H2O]![]() 2Al2O3+2NH3↑+N2↑+5SO3↑+3SO2↑+53H2O,
2Al2O3+2NH3↑+N2↑+5SO3↑+3SO2↑+53H2O,
将产生的气体通过下图所示的装置。
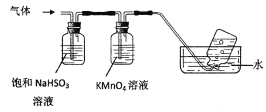
①集气瓶中收集到的气体是_____________________(填化学式)。
②KMnO4溶液褪色,发生的离子反应方程式为_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应N2O4![]() 2NO2在温度一定时,平衡体系中NO2的体积分数V(NO2)%随压强的变化情况如图所示(实线上的任何一点为对应压强下的平衡点)。下列说法正确的是
2NO2在温度一定时,平衡体系中NO2的体积分数V(NO2)%随压强的变化情况如图所示(实线上的任何一点为对应压强下的平衡点)。下列说法正确的是
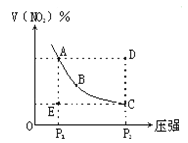
A、A、C两点的正反应速率的关系A>C
B、A、B、C、D、E各状态,V正>V逆的是状态D
C、使E状态从水平方向到达C状态,从理论上来讲,
可选用的条件是从P1突然加压至P2
D、维持P1不变,E→A所需时间为x,维持P2不变,D→C所需
时间为y,则x<y
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F六种化合物,其中A、B、C、D、E均由短周期元素组成,焰色反应均为黄色,B、C、E均由三种元素组成。B、C的组成元素相同,且C的摩尔质量比B大80g/mol,回答:
(1)固体化合物A为浅黄色粉末,该化合物中含有的化学键为
A.离子键B.极性共价键C.非极性共价键D.氢键
(2)下表为B与F实验的部分内容
①在含B的溶液中加入稀H2SO4,产生浅黄色浑浊和使澄清石灰水变浑浊的无色有刺激性气味的气体 |
②20mL沸水中滴加F的饱和溶液1~2mL所得液体呈红褐色 |
③将实验②得到的红褐色液体加热蒸发,灼烧,最终得到红棕色固体 |
写出B与稀H2SO4反应的离子方程式
写出②中反应的化学方程式
(3).现由6种粒子Mn2+、MnO4-、H+、H2O、X2Y82-(C中含有的阴离子),XY42-完成一个离子方程式,已知Mn2+为还原剂,得到1molMnO4-需氧化剂的物质的量为mol
(4).化合物D和E相互转化D![]() E,若有D和E·
E,若有D和E·![]() H2O的混合物13.04g,加热到完全反应后,气体产物通过浓H2SO4增重3.42g,剩余气体通过碱石灰增重2.20g,则混合物中D的质量为g,E·
H2O的混合物13.04g,加热到完全反应后,气体产物通过浓H2SO4增重3.42g,剩余气体通过碱石灰增重2.20g,则混合物中D的质量为g,E·![]() H2O的化学式为
H2O的化学式为
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C是由周期表中短周期元素组成的三种常见化合物,甲、乙、丙是三种单质,这些单质和化合物之间存在如图1所示的关系,完成下列空白:

(1)向酚酞试液中加入化合物A的粉末,现象为_____________。
(2)单质甲与化合物B反应的离子方程式为_______________。
(3)向20mL某浓度的化合物C的溶液中通入CO2气体后得溶液M,因CO2通入量的不同,溶液M的组成也不同。若向M中逐滴加入0.1mol/L盐酸,产生的气体体积V(CO2)与加入盐酸的体积V(HCl)的关系如图2图示两种情况。

①由A确定滴加前60mL的盐酸时,发生反应的离子方程式为_________。
②由B表明,原溶液通入CO2气体后,所得溶液中的溶质的化学式为________。
③由A、B可知,两次实验通入的CO2的体积比为__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com