
将少量金属钠分别投入下列物质的水溶液中,有气体放出,且溶液质量减轻的是( )
|
| A. | HCl | B. | NaOH | C. | K2SO4 | D. | MgSO4 |
| 钠的化学性质. | |
| 专题: | 金属概论与碱元素. |
| 分析: | 钠和水反应生成氢氧化钠和水,溶液质量减轻,说明从溶液中放出气体的质量大于溶液增加的质量. |
| 解答: | 解:钠和水的反应方程式为:2Na+2H2O=2NaOH+H2↑,根据方程式知,溶液增加的质量=m(Na)﹣m(H2), A、钠和水的反应方程式为:2Na+2H2O=2NaOH+H2↑,生成的氢氧化钠和盐酸反应生成盐和水,反应方程式为:NaOH+HCl=NaCl+H2O,所以溶液质量增加,溶液增加的质量=m(Na)﹣m(H2),故A不符合. B、钠和水的反应方程式为:2Na+2H2O=2NaOH+H2↑,所以溶液质量增加,溶液增加的质量=m(Na)﹣m(H2),故B不符合. C、钠和水的反应方程式为:2Na+2H2O=2NaOH+H2↑,生成的氢氧化钠和硫酸钾不反应,所以溶液增加的质量=m(Na)﹣m(H2),故C不符合. D、钠和水的反应方程式为:2Na+2H2O=2NaOH+H2↑,生成的氢氧化钠和硫酸镁反应,反应方程式为:2NaOH+MgSO4=Na2SO4+Mg(OH)2↓,将两个方程式相加得2Na+2H2O+MgSO4=H2↑+Na2SO4+Mg(OH)2↓,根据方程式知,溶液的离子减少,减轻的质量=m(Mg(OH)2)﹣m(Na)+m(H2),故D符合. 故选D. |
| 点评: | 本题考查了钠及氢氧化钠的性质,难度不大,注意根据方程式利用差量法分析反应后溶液质量的变化. |


 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案科目:高中化学 来源: 题型:
主链为5个碳原子的C7H16的同分异构体中,其中一种同分异构体A的核磁共振氢谱有3个峰且面积比为1︰1︰6,则A的一氯代物的同分异构体的数目为( )
A.2 B.3  C.4
C.4  D.5
D.5
查看答案和解析>>
科目:高中化学 来源: 题型:
焦亚硫酸钠(Na2S2O5)是常用的食品抗氧化剂之一。某研究小组进行如下实验:
实验一 焦亚硫酸钠的制取
采用右图装置(实验前已除尽装置内的空气)制取Na2S2O 5。装置II中有Na2S2O5晶体析出,发生的反应为:Na2SO3+SO2=Na2S2O5
5。装置II中有Na2S2O5晶体析出,发生的反应为:Na2SO3+SO2=Na2S2O5
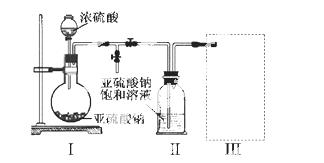
(1)装置I中产生气体的化学方程式为 。
(2)要从装置II中获得已析出的晶体,可采取的分离方法是 。
(3)装置III用于处理尾气,可选用的最合理装置(夹持仪器已略去)为 (填序号)。
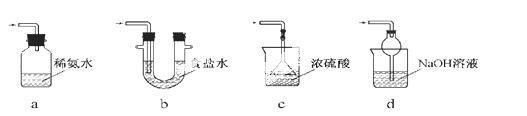
实验二 焦亚硫酸钠的性质
Na2S2O5溶于水即生成NaHSO3。
(4)证明NaHSO3溶液中HSO3- 的电离程度大于水解程度,可采用的实验方法是 (填序号)。
a.测定溶液的pH b.加入Ba(OH)2溶液 c.加入盐酸
d.加入品红溶液 e.用蓝色石蕊试纸检测
(5)检验Na2S2O5晶体在空气中已被氧化的实验方案是 。
实验三 葡萄酒中抗氧化剂残留量的测定
(6)葡萄酒常用Na2S2O5作抗氧化剂。测定某葡萄酒中抗氧化剂的残留量(以游离SO2计算)的方案如下:

(已知:滴定时反应的化学方程式为SO2+I2+2H2O=H2SO4+2HI)
①按上述方案实验,消耗标准I2溶液25.00 mL,该次实验测得样品中抗氧化剂的残留量(以游离SO2计算)为 g·L-1。
②在上述实验过程中,若有部分HI被空气氧化,则测得结果 (填“偏高”“偏低”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知甲、乙、丙、X是4种中学化学中常见的物质,其转化关系符合如图.则甲和X(要求甲和X能互换)不可能是[提示:Al3++3AlO2﹣+6H2O=4Al(OH)3↓]( )
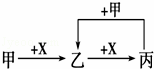
A. C和O2 B. SO2和NaOH溶液
C. Cl2和Fe D. AlCl3溶液和NaOH溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
某氧化物不溶于水,溶于熔化的NaOH中,生成易溶于水的化合物,向稀盐酸中滴加所生成化合物的水溶液,立即有白色沉淀产生,则原氧化物是( )
|
| A. | Al2O3 | B. | MgO | C. | SiO2 | D. | P2O5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y、Z、W是短周期的4种元素,有关他们的信息如下表所示.
| 元素 | 部分结构知识 | 部分性质 |
| X | X的单质由双原子分子构成,分子中有14个电子 | X有多种氧化物,如XO、XO2、X2O4等;通常情况下XO2与X2O4共存 |
| Y | Y原子的次外层电子数等于最外层电子数的一半 | Y能形成多种气态氢化物 |
| Z | Z原子的最外层电子数多于4 | Z元素的最高正化合价与最低负化合价代数和等于6 |
| W | W原子的最外层电子数等于2n﹣3(n为原子核外电子层数) | 化学反应中,W原子易失去最外层电子形成与Ne原子电子层结构相同的Wn+ |
填写下列空白(提示:不能用字母X、Y、Z、W作答):
(1)X的气态氢化物分子的结构式是 ,Z元素在周期表中的位置是 .
(2)X、Y、Z三元素的最高价氧化物对应的水化物酸性由强到弱的顺序是 .
(3)常温时,W的硫酸盐溶液的pH 7(填“=”“>”或“<”).理由是 (用离子方程式表示).
(4)实验室用X的氢化物的水溶液制取W的氢氧化物的方法是 (用离子方程式表示).
(5)W与氧化铁反应的化学方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
在10 L密闭容器中,1 mol A和3 mol B在一定条件下反应:A(g)+xB(g)  2C(g),
2C(g),
2 min后达到平衡,生成0.4 mol C,测得混合气体共3.4 mol,则下列结果正确的是
A.平衡时,物质的量之比n(A)∶n(B)∶n(C)=2∶11∶4
B.x值等于3
C.A的转化率为20%
D.B的平均反应速率为0.4 mol/(L·min)
查看答案和解析>>
科目:高中化学 来源: 题型:
减压吸滤装置和普通的过滤装置相比,除可加快过滤速度外,还具有的优点是
A.可过滤胶状沉淀 B.可过滤颗粒更小的沉淀
C.可得到较干燥的沉淀 D.可使沉淀中的杂质减少
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com