
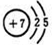 .
.分析 (1)氮原子核外有2个电子层,最外层电子数为5;
(2)氧化物为二氧化硫,具有还原性,与氯化铁发生氧化还原反应;
(3)A.最高价氧化物的水化物的酸性越强,非金属性越强;
B.元素的气态氢化物越稳定,则元素的非金属性越强;
C.非金属性强的元素显示负价,非金属性弱的则显示正价;
D.非金属性与溶解性无关.
解答 解:(1)氮原子序数是7,氮原子的结构示意图为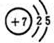 ,故答案为:
,故答案为: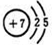 ;
;
(2)二氧化硫可用于漂白纸浆、丝、草帽辫等并能用于杀菌、消毒;FeCl3溶液能将二氧化硫氧化为硫酸,方程式:2Fe3++SO2+2H2O=2 Fe2++SO42-+4H+,故答案为:2Fe3++SO2+2H2O=2 Fe2++SO42-+4H+;
(3)A.pH小的酸性强,最高价氧化物的水化物的酸性越强,非金属性越强,故A正确;
B.元素的气态氢化物越稳定,则元素的非金属性越强,与酸的稳定性越强,故B错误;
C.S的非金属性强于C,S显负价,碳元素显示正价,故C正确;
D.非金属性与溶解性无关,故D错误.
故答案为:A、C.
点评 本题考查较综合,涉及氧化还原反应、元素的位置及性质、非金属性的比较等,综合性较强,注重高频考点的考查,有利于基础知识的夯实,题目难度不大.


 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案科目:高中化学 来源: 题型:选择题
| A. | 浓硫酸具有吸水性,因而能使蔗糖炭化 | |
| B. | 浓硫酸有氧化性,稀硫酸无氧化性 | |
| C. | 浓硫酸是一种干燥剂,能够干燥氨气、氢气等气体 | |
| D. | 稀释浓硫酸时,应将其沿着器壁慢慢加入到水中,并用玻璃棒不断搅拌 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 铁、铝是应用最广泛的两种金属.完成下列填空:
铁、铝是应用最广泛的两种金属.完成下列填空:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 上海世博会很多场馆的外墙使用的非晶体薄膜,以充分利用天阳能,体现低碳经济 | |
| B. | 金属的电化学防护措施有牺牲阳极的阴极保护法和外加电流的阴极保护法 | |
| C. | 若在水果贮藏室中,放几块被KMnO4溶液浸透过的“砖块”,可延长水果保存时间 | |
| D. | 常温时,某可逆反应的平衡常数越大则其反应速率就越快 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Y的低价氧化物、Z的单质水溶液均具有漂白性,且与O3漂白的原理相同 | |
| B. | X与Z形成的化合物和W2Y的晶体类型相同 | |
| C. | 工业上常用电解相应的盐溶液制备W、X、Z的单质 | |
| D. | X元素的盐溶液可能呈酸性,也可能呈碱性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 葡萄糖可通过酒化酶水解生成酒精 | |
| B. | 分子式为CH4O和C2H6O的物质一定互为同系物 | |
| C. | 向植物油中加入酸性高锰酸钾紫色溶液,振荡后,酸性高锰酸钾溶液颜色褪去 | |
| D. | 淀粉溶液与稀硫酸溶液共热,再加入新制氢氧化铜悬浊液加热,无红色沉淀,则可证明淀粉没有水解 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
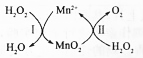 MnSO4可用作催化剂和生产微量元素肥料等,回答下列问题:
MnSO4可用作催化剂和生产微量元素肥料等,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
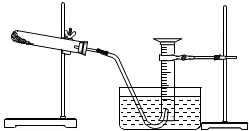 某同学完成以胆矾为原料制取氧化铜固体实验,并用氧化铜和氯酸钾的混合物制取氧气,测量生成氧气的体积.试回答:
某同学完成以胆矾为原料制取氧化铜固体实验,并用氧化铜和氯酸钾的混合物制取氧气,测量生成氧气的体积.试回答:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应是分解反应 | B. | 该反应的熵增效应大于焓变效应 | ||
| C. | 该反应是熵减反应 | D. | 该反应是放热反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com