
【题目】短周期元素 m、n、p、q 在元素周期表中的排列如图所示,其中 n 的最高价氧化对应的水化物既能与强酸反应,也能与强碱反应,下列说法正确的是( )
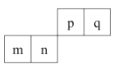
A.元素n位于元素周期表第3周期,第ⅢA族
B.单质与水反应置换出氢气的能力:m<n
C.简单离子半径:m>q
D.最高价氧化物对应水化物的碱性:m<n
【答案】A
【解析】
短周期元素m、n、p、q在元素周期表中的排列如图所示,其中n的最高价氧化对应的水化物既能与强酸反应,也能与强碱反应,则n为Al,结合各元素的相对位置可知,m为Mg,p为C,q为N元素,据此解答。
根据分析可知,m为Mg,n为Al,p为C,q为N元素。
A. Al的原子序数为13,位于元素周期表第3周期第ⅢA族,故A正确;
B. 金属性:Mg>Al,则单质与水反应置换出氢气的能力:m>n,故B错误;
C. 镁离子和氮离子含有2个电子层,核电荷数越大离子半径越小,则离子半径:m<q,故C错误;
D. 金属性:Mg>Al,则最高价氧化物对应水化物的碱性:m>n,故D错误;
故选:A。


科目:高中化学 来源: 题型:
【题目】为回收利用废镍催化剂(主要成分为NiO,另含Fe2O3、CaO、CuO、BaO等),科研人员研制了一种回收镍的新工艺。工艺流程如图:
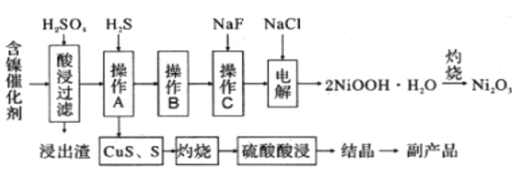
已知:①常温下,有关氢氧化物开始沉淀和沉淀完全的pH如表
氢氧化物 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
开始沉淀的pH | 1.5 | 6.5 | 7.7 |
沉淀完全的pH | 3.7 | 9.7 | 9.2 |
②常温下,Ksp(CaF2)= 2.7×10-11
回答下列问题:
(1)加快酸浸速率的常用措施有_____________(任写一条)。
(2)写出酸浸时Fe2O3和硫酸反应的离子方程式________________________________。
(3)浸出渣主要成分为CaSO4·2H2O和______________两种物质。
(4)操作B的过程是先在40~50℃加入H2O2,其作用是___________________________(用离子方程式表示);再调节PH至3.7~7.7,操作B可除去溶液中的______元素(填元素名称)。
(5)操作C可除去溶液中的Ca2+,若控制溶液中F-浓度为3×10-3mol/L,则溶液中c(Ca2+):c(F-) =___________________。
(6)在碱性条件下,电解产生2NiOOH·H2O的原理分两步:
① Cl- 在阳极被氧化为ClO-,则阳极的电极反应为_____________________。
② Ni2+ 被ClO-氧化产生2NiOOH·H2O沉淀,则该步反应的离子方程式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,在20.00 mL 0.1000 mol·L-1 NH3·H2O溶液中逐滴滴加0.1000 mol·L-1 HCl溶液,溶液pH随滴入HCl溶液体积的变化曲线如图所示。下列说法正确的是
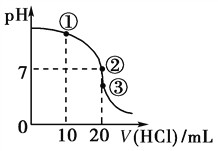
A. ①溶液:c(Cl-)>c(NH)>c(OH-)>c(H+)
B. ②溶液:c(NH)=c(Cl-)>c(OH-)=c(H+)
C. ①、②、③三点所示的溶液中水的电离程度②>③>①
D. 滴定过程中不可能出现:c(NH3·H2O)>c(NH)>c(OH-)>c(Cl-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积不变的密闭容器中进行反应:2SO2(g)+O2(g)![]() 2SO3(g) ΔH<0。下列各图表示当其他条件不变时,改变某一条件对上述反应的影响,其中分析正确的是
2SO3(g) ΔH<0。下列各图表示当其他条件不变时,改变某一条件对上述反应的影响,其中分析正确的是
A. 图 表示温度对平衡的影响,且甲温度较高
表示温度对平衡的影响,且甲温度较高
B. 图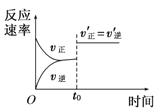 表示t0时刻恒容充入He(g)
表示t0时刻恒容充入He(g)
C. 图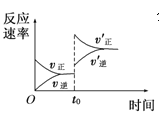 表示t0时刻增大O2的浓度对反应速率的影响
表示t0时刻增大O2的浓度对反应速率的影响
D. 图 中a点v正 > v逆
中a点v正 > v逆
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组运用如图所示组合装置(部分夹持装置未画出)进行探究实验。
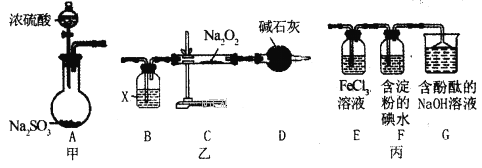
请回答下列问题:
(1)A同学将甲、乙装置组合进行实验,其实验目的是探究__反应的生成物;在连接好装置后,首先要进行的实验操作为___。
(2)为检验C装置中反应生成物是否有氧气,装置B中盛放的试剂X应为__,装置D中碱石灰的作用是__;
(3)B同学将甲、丙装置组合进行实验,能说明I-的还原性弱于SO2的现象为__,发生反应的离子方程式是__。
(4)装置G中的现象是__,说明SO2具有__性。
(5)为验证装置E中SO2与FeCl3发生了氧化还原反应,C同学设计了两套方案,完成下表:
实验操作 | 实验现象 | 实验结论 | |
方案1 | 取少量装置E中的溶液于试管中,向其中滴加___溶液 | 产生白色沉淀 | SO2与FeCl3发生了氧化还原反应 |
方案2 | 取少量装置E中的溶液于试管中,向其中滴加___溶液 | ___ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空。
(1)浓度均为0.1 mol/L的①硫酸 ②醋酸 ③氢氧化钠 ④氯化铵四种溶液中由水电离出的H+浓度由大到小的顺序是 (填序号)。
(2)Fe2(SO4)3溶液显酸性,用离子方程式表示其原因___________________。
(3)AlCl3溶液和NaAlO2溶液混合的化学方程式为______________________。
(4)向饱和FeCl3溶液中加入CaCO3粉末,发现碳酸钙逐渐溶解,同时还产生的现象有____________________。
(5)常温下,将0.2 mol/L CH3COOH和0.1 mol/L NaOH溶液等体积混合,所得溶液的pH<7,该混合溶液中离子浓度由大到小的顺序是_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于可逆反应4NH3(g)+5O2(g) ![]() 4NO(g)+6H2O(g),下列叙述正确的是( )
4NO(g)+6H2O(g),下列叙述正确的是( )
A.化学平衡常数的表达式K=![]()
B.当v正(NH3)∶v正(NO)=1∶1时,说明该化学反应已经达到平衡状态
C.若达到平衡状态时两种反应物的转化率相等,则起始投入时n(NH3)∶n(O2)=4∶5
D.反应达到平衡状态后,改变条件使平衡向正反应方向移动,c(H2O)一定增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个1L的密闭容器中加2molA和1molB发生反应: 2A(g)+B(g)![]() 3C(g)+D(s),达到平衡时C的浓度为1.2mol/L , C的体积分数为a% 。维持容器的体积和温度不变,按下列配比作为起始物质,达到平衡后,C的浓度仍是1.2mol/L,C的体积分数仍为a% 的是
3C(g)+D(s),达到平衡时C的浓度为1.2mol/L , C的体积分数为a% 。维持容器的体积和温度不变,按下列配比作为起始物质,达到平衡后,C的浓度仍是1.2mol/L,C的体积分数仍为a% 的是
A. 6mol C+2mol D B. 4mol A+2mol B
C. 1mol A+0.5mol B+1.5mol C D. 3mol C+5mol D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化氮存在下列平衡2NO2 (g) ![]() N2O4(g);△H<0。在测定NO2 相对分子质量时,下列条件中较为适宜的是
N2O4(g);△H<0。在测定NO2 相对分子质量时,下列条件中较为适宜的是
A.温度130℃,压强3.03×105paB.温度25℃, 压强1.01×105pa
C.温度130℃,压强5.05×104paD.温度0℃, 压强5.05×104pa
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com