
| A. | 蒸发结晶操作时,当有大量晶体析出时停止加热,用余热蒸干 | |
| B. | 蒸馏操作时,应使温度计水银球插入液态混合物中 | |
| C. | 分液操作时,分液漏斗中下层液体从下口流出,上层液体从上口倒出 | |
| D. | 萃取操作时,萃取剂要和原溶剂互不相溶,且不能与溶质和溶剂反应 |
分析 A.蒸发时,不能蒸干,利用余热加热;
B.蒸馏时,测定馏分的温度;
C.分液时,避免上下层液体混合;
D.萃取时,溶质在互不相溶的溶剂中溶解性不同.
解答 解:A.蒸发时,不能蒸干,利用余热加热,则当有大量晶体析出时停止加热,故A正确;
B.蒸馏时,测定馏分的温度,则应使温度计水银球在蒸馏烧瓶的支管口处,故B错误;
C.分液时,避免上下层液体混合,则分液漏斗中下层液体从下口流出,上层液体从上口倒出,故C正确;
D.萃取时,萃取剂要和原溶剂互不相溶,且不能与溶质和溶剂反应,与溶解性差异有关,不需要考虑密度,故D正确;
故选B.
点评 本题考查化学实验方案的评价,为高频考点,把握混合物分离提纯实验、实验操作及技能为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
 ,与N3-互为等电子体的分子为N2O(写一种);
,与N3-互为等电子体的分子为N2O(写一种);查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 A、B、D、E、F五种元素的原子序数依次增大,除F为过渡元素外,其余四种均是短周期元素.已知:
A、B、D、E、F五种元素的原子序数依次增大,除F为过渡元素外,其余四种均是短周期元素.已知:查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 原子序数依次增大的A、B、C、D、E、F六种元素.其中A的基态原子有3个不同能级,各能级中的电子数相等;C的基态原子2p能级上的未成对电子数与A原子的相同;D为它所在周期中原子半径最大的主族元素;E、F和C位于同一主族,F处于第一个长周期.
原子序数依次增大的A、B、C、D、E、F六种元素.其中A的基态原子有3个不同能级,各能级中的电子数相等;C的基态原子2p能级上的未成对电子数与A原子的相同;D为它所在周期中原子半径最大的主族元素;E、F和C位于同一主族,F处于第一个长周期.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
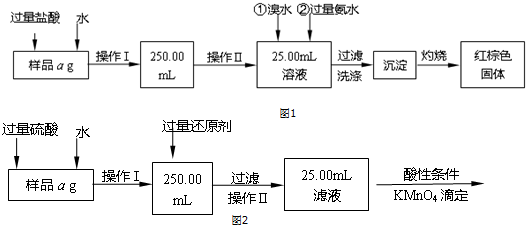
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
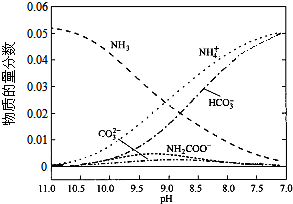
| A. | 在pH=9.0时,c(NH4+)>c(HCO3-)>c(NH2COOˉ)>c(CO32-) | |
| B. | 随着CO2的通入,$\frac{c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$不断增大 | |
| C. | 不同pH的溶液中存在关系:c(NH4+)+c(H+)═2c(CO32-)+c(HCO3-)+c(NH2COO-)+c(OH-) | |
| D. | 在溶液中pH不断降低的过程中,有含NH2COOˉ的中间产物生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
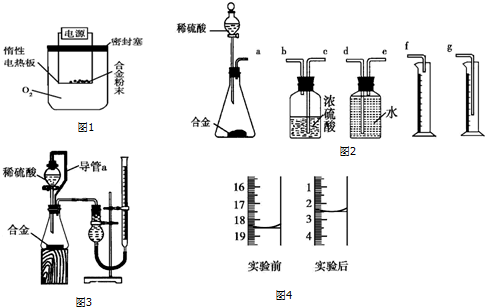
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com