
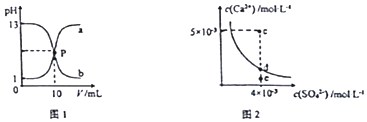
| A. | 图1中P点溶液:c(Na+ )=c(Cl-)>c(H+ )=c(OH- ) | |
| B. | 由图1可知盐酸和NaOH溶液的浓度均为1mol•L-1 | |
| C. | 图2中c点有沉淀生成,达平衡后溶液中c(SO42- )=3×10-3 mol•L-1 | |
| D. | 可通过蒸发将图 2中e点的溶液变到d点 |
分析 A、P点是盐酸与氢氧化钠恰好完全反应得到单一的氯化钠;
B、由图1中a是盐酸、曲线b是氢氧化钠,根据溶液的PH求溶液的浓度;
C.c点Qc>Ksp,有沉淀生成;
D.蒸发使离子浓度增大,e点的溶液变到d点.
解答 解:A、P点是盐酸与氢氧化钠恰好完全反应得到单一的氯化钠,溶液呈中性,离子浓度大小为:c(Na+ )=c(Cl-)>c(H+ )=c(OH- ),故A正确;
B、由图1中a是盐酸、曲线b是氢氧化钠,PH=1的盐酸,盐酸的浓度为0.1mol/L,PH=13的氢氧化钠,则氢氧化钠的物质的量浓度为:0.1mol/L,而不是1mol/L,故B错误;
C.根据图示数据,可以看出c点Qc=2×l0-5>Ksp,所以会生成沉淀,平衡向生成沉淀的方向进行,由于c点c(Ca2+)>c(SO42-),生成沉淀时两者减少的离子数目相同,Ksp(CaSO4)=9×10-6,则平衡后(Ca2+)>c(SO42-),c(SO4-)小于3×l0-3mol/L,故C错误;
D.d为不饱和溶液,蒸发时硫酸根的浓度会增大,所以e点溶液通过蒸发不能变到d点,故D错误;
故选:A.
点评 本题考查了沉淀溶解平衡的应用,图象分析应用,溶度积计算分析,电解液的判断,关键是计算混合溶液中钙离子浓度和硫酸根离子浓度,题目难度中等.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 陶瓷是硅酸盐产品 | B. | 葡萄糖可用于制镜业 | ||
| C. | 纸的主要成分为纤维素 | D. | 汉白玉的主要成分碳酸钙属于碱类 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径Y>Z>X | |
| B. | X分别与Y、Z形成的化合物均至少有两种 | |
| C. | 最高价氧化物对应水化物的酸性:W>Z | |
| D. | 氢元素在与X、Y、Z分别形成的化合物中,化合价均为+1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
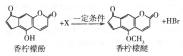 香柠檬油可用于化妆品生产.香柠檬油中含有微量的香柠檬酚和香柠檬醚,二者之间存在如下转化关系,下列说法错误的是( )
香柠檬油可用于化妆品生产.香柠檬油中含有微量的香柠檬酚和香柠檬醚,二者之间存在如下转化关系,下列说法错误的是( )| A. | 香柠檬酚和香柠檬醚均可与NaOH溶液反应 | |
| B. | 香柠檬酚使溴水、酸性KMnO4溶液褪色的原理相同 | |
| C. | X是CH3Br,相应的反应是取代反应 | |
| D. | 1mol香柠檬酚和1mol香柠檬醚分别完全燃烧时,后者耗氧量比前者多1.5mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
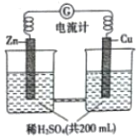 如图所示由锌片、铜片和稀H2SO4(密度为1.25g•cm-3)组成的原电池,一段时间后,若锌片只发生电化学反应,当在铜片上放出1.68L(标准状况下)气体时,H2SO4恰好梢耗一半,则原硫酸溶质的质量分数为( )
如图所示由锌片、铜片和稀H2SO4(密度为1.25g•cm-3)组成的原电池,一段时间后,若锌片只发生电化学反应,当在铜片上放出1.68L(标准状况下)气体时,H2SO4恰好梢耗一半,则原硫酸溶质的质量分数为( )| A. | 0.75% | B. | 2.94% | C. | 5.88% | D. | 11.76% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com