
分析 (一)(1)根据实验步骤可知,加入加过量的Ba(OH)2溶液和过量的Na2CO3溶液能除去粗盐中的Ca2+、SO42-、Mg2+等杂质离子,然后过滤除去生成的沉淀,再加盐酸除去过量的氢氧根和碳酸根离子,据此分析;
(2)加入Na2CO3溶液不但要除去Ca2+,还要除去过量的Ba2+,据此分析离子方程式;
(二)(3)根据配制步骤是计算、称量、溶解、冷却、移液、洗涤、定容、装瓶来分析操作步骤;
(4)根据配制步骤是计算、称量、溶解、冷却、移液、洗涤、定容、摇匀、装瓶来分析需要的仪器和玻璃棒的作用;
(5)根据c=$\frac{n}{V}$并结合溶质的物质的量n和溶液的体积V的变化来进行误差分析;
解答 解:(一)(1)根据实验步骤可知,加入加过量的Ba(OH)2溶液和过量的Na2CO3溶液能除去粗盐中的Ca2+、SO42-、Mg2+等杂质离子,然后过滤除去生成的沉淀,再加盐酸除去过量的氢氧根和碳酸根离子,故步骤e是加入过量的盐酸,故答案为:盐酸;
(2)加入Na2CO3溶液不但要除去Ca2+,还要除去过量的Ba2+,故离子方程式为:Ca2++CO32-=CaCO3↓ Ba2++CO32-=BaCO3↓,故答案为:Ca2++CO32-=CaCO3↓ Ba2++CO32-=BaCO3↓;
(二)(3)根据配制步骤是计算、称量、溶解、冷却、移液、洗涤、定容、装瓶可知所缺少的是定容,故答案为:定容;
(4)根据配制步骤是计算、称量、溶解、冷却、移液、洗涤、定容、摇匀、装瓶可知所需的仪器有玻璃棒、烧杯、胶头滴管、100mL容量瓶,其中玻璃棒的作用有搅拌和引流,故答案为:100mL容量瓶;搅拌、引流;
(5)A.容量瓶中原有少量的蒸馏水对浓度无影响,故A错误;
B.移液时,不慎将液体流到瓶外,则导致溶质的损失,则浓度偏小,故B正确;
C.容量瓶盛过NaCl溶液,使用前未洗涤,则会导致溶质的量偏多,浓度偏高,故C错误;
D.定容时俯视刻度线,则溶液体积偏小,浓度偏高,故D错误.
故选B.
点评 本题考查了一定物质的量浓度溶液的配制过程中的计算和误差分析,属于基础型题目,难度不大.


 春雨教育同步作文系列答案
春雨教育同步作文系列答案科目:高中化学 来源: 题型:选择题
| A. | 加入BaCl2溶液,产生了白色沉淀.则溶液中一定含有SO42- | |
| B. | 加入BaCl2溶液产生了白色沉淀,再加盐酸,沉淀不消失,则溶液中一定含有SO42- | |
| C. | 加入盐酸酸化的氯化钡溶液,产生白色沉淀,则溶液中一定有SO42- | |
| D. | 加入盐酸,溶液无明显现象,再加BaCl2溶液,产生了白色沉淀.则溶液中一定含有SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ④⑤ | B. | ②④ | C. | ①② | D. | ③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v (NH3)=0.3 mol•L-1•min-1 | B. | v (H2)=0.3mol•L-1•min-1 | ||
| C. | v(N2)=0.2 mol•L-1•min-1 | D. | v (N2)=0.05mol•L-1•s-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯和甲烷都能发生加成反应 | |
| B. | 煤焦油、石油、花生油都属于烃 | |
| C. | 甲烷、乙烯、苯都可通过石油分馏得到 | |
| D. |  + +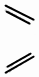 $\stackrel{△}{→}$ $\stackrel{△}{→}$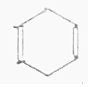 反应属于加成反应 反应属于加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 中和热测定实验用的小烧杯和物质的量浓度溶液配制用的容量瓶都必须干燥 | |
| B. | 用已知浓度的盐酸滴定未知浓度的氢氧化钠溶液,若滴定终点时仰视读数,测得氢氧化钠浓度偏低 | |
| C. | 配制2.0 mol•L-1的硫酸,若定容时俯视,则所得溶液浓度偏高(其他操作均正确) | |
| D. | 用铜电极电解2.0 mol•L-1的硫酸,阴阳两极生成气体的体积之比为2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 气体的密度发生了变化 | B. | 气体的平均分子量发生了变化 | ||
| C. | 气体的颜色发生了变化 | D. | 体系的温度发生了变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com