


 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案科目:高中化学 来源: 题型:阅读理解
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
 SO2是一种重要的化工原料,也是引起酸雨污染的重要来源.
SO2是一种重要的化工原料,也是引起酸雨污染的重要来源.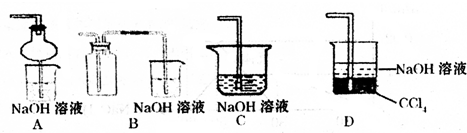
查看答案和解析>>
科目:高中化学 来源: 题型:
SO2是一种重要的化工原料,也是引起酸雨污染的重要来源。
(1)下列有关酸雨的说法正确的是 (填序号)。
A. SO2、NO2或CO2都会导致酸雨的形成
B. NO不溶于水,所以不会造成酸雨污染
C. 燃煤时鼓入足量空气,可以减少酸雨的产生
D. 采用清洁能源,可以减少酸雨的产生
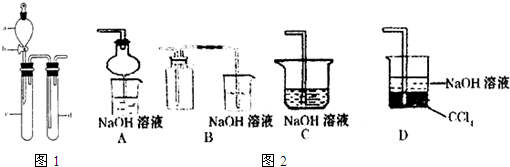
(2)某兴趣小组采用右图装置制取并探究SO2气体的性质。
①下列实验方案适用于用右图所示装置制取所需SO2的是 (填序号)。
A. Na2SO3溶液与HNO3 B. Na2SO3固体与浓硫酸
C. 固体硫在纯氧中燃烧 D.铜与浓H2SO4
②组装完仪器后,检查装置气密性的方法是:关闭活塞b,
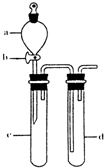
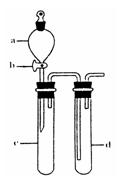
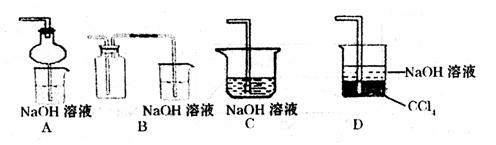
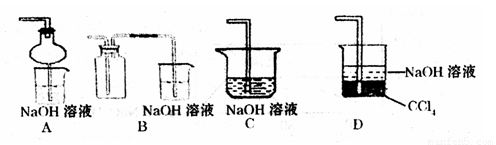
③指导老师指出应增加一尾气吸收装置,并帮助同学们设计了如下装置,其中合理的是
(填序号)。
④小组同学设计在试管d中加入FeCl3溶液,验证SO2的还原性。为了验证SO2与Fe3+发生了氧化还原反应,他们在通入足量SO2后,取试管d中的溶液,分成三份,并设计了如下实验:
方案A:往第一份试液中加入KmnO4溶液,紫红色褪去
方案B:往第二份试液加入KSCN溶液,不变红,再加入新制的氯水,溶液变红
方案C:往第三份试液加入用稀盐酸酸化的BaCl2,产生白色沉淀。
上述方案不合理的是 原因是
查看答案和解析>>
科目:高中化学 来源:2011届山东省临沂市高三上学期期中考试化学试题 题型:实验题
SO2是一种重要的化工原料,也是引起酸雨污染的重要来源。
(1)下列有关酸雨的说法正确的是 (填序号)。
A. SO2、NO2或CO2都会导致酸雨的形成
B. NO不溶于水,所以不会造成酸雨污染
C. 燃煤时鼓入足量空气,可以减少酸雨的产生
D. 采用清洁能源,可以减少酸雨的产生
(2)某兴趣小组采用右图装置制取并探究SO2气体的性质。
①下列实验方案适用于用右图所示装置制取所需SO2的是 (填序号)。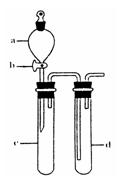
A. Na2SO3溶液与HNO3 B. Na2SO3固体与浓硫酸
C. 固体硫在纯氧中燃烧 D.铜与浓H2SO4
②组装完仪器后,检查装置气密性的方法是:关闭活塞b,
③指导老师指出应增加一尾气吸收装置,并帮助同学们设计了如下装置,其中合理的是
(填序号)。
④小组同学设计在试管d中加入FeCl3溶液,验证SO2的还原性。为了验证SO2与Fe3+发生了氧化还原反应,他们在通入足量SO2后,取试管d中的溶液,分成三份,并设计了如下实验:
方案A:往第一份试液中加入KmnO4溶液,紫红色褪去
方案B:往第二份试液加入KSCN溶液,不变红,再加入新制的氯水,溶液变红
方案C:往第三份试液加入用稀盐酸酸化的BaCl2,产生白色沉淀。
上述方案不合理的是 原因是
查看答案和解析>>
科目:高中化学 来源:2010-2011学年山东省临沂市高三上学期期中考试化学试题 题型:实验题
SO2是一种重要的化工原料,也是引起酸雨污染的重要来源。
(1)下列有关酸雨的说法正确的是 (填序号)。
A. SO2、NO2或CO2都会导致酸雨的形成
B. NO不溶于水,所以不会造成酸雨污染
C. 燃煤时鼓入足量空气,可以减少酸雨的产生
D. 采用清洁能源,可以减少酸雨的产生
(2)某兴趣小组采用右图装置制取并探究SO2气体的性质。
①下列实验方案适用于用右图所示装置制取所需SO2的是 (填序号)。
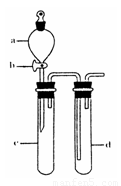
A. Na2SO3溶液与HNO3 B. Na2SO3固体与浓硫酸
C. 固体硫在纯氧中燃烧 D.铜与浓H2SO4
②组装完仪器后,检查装置气密性的方法是:关闭活塞b,
③指导老师指出应增加一尾气吸收装置,并帮助同学们设计了如下装置,其中合理的是
(填序号)。
④小组同学设计在试管d中加入FeCl3溶液,验证SO2的还原性。为了验证SO2与Fe3+发生了氧化还原反应,他们在通入足量SO2后,取试管d中的溶液,分成三份,并设计了如下实验:
方案A:往第一份试液中加入KmnO4溶液,紫红色褪去
方案B:往第二份试液加入KSCN溶液,不变红,再加入新制的氯水,溶液变红
方案C:往第三份试液加入用稀盐酸酸化的BaCl2,产生白色沉淀。
上述方案不合理的是 原因是
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com