
| A. | 加碘食盐是在食盐中加入了碘的化合物 | |
| B. | 钙营养盐是在食盐中加入了氯化钙或碳酸钙等含钙的化合物 | |
| C. | 低钠盐中的钠离子比氯离子少,所以低钠盐是一种带负电的物质 | |
| D. | 各类营养盐的主要成分都是氯化钠 |
科目:高中化学 来源: 题型:选择题
| A. | 在20 g D216O中含有10NA个电子 | |
| B. | 标准状况下,2.24 L己烷所含分子数为0.1NA | |
| C. | 1 mol Cl2参加反应转移电子数一定为2NA | |
| D. | 含NA个Na+的Na2O溶解于1 L水中,Na+的物质的量浓度为1 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 小芳认为,人体缺乏下列元素,会得不同疾病.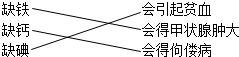 | |
| B. | 小槐搜集资料发现,生活中人们常通过下列途径来补充人体必需的营养元素.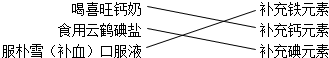 | |
| C. | 小蓉为下列元素各设计了一句广告词来反映其对人体的重要作用. | |
| D. | 小红搜集资料发现,长期或大量摄入铝元素对人体的大脑和神经系统将造成损害,他提出下列建议: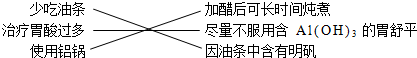 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol•L-1 | B. | 0.2 mol•L-1 | C. | 0.3 mol•L-1 | D. | 0.4 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 硫-碘循环分解水制氢主要涉及下列反应:
硫-碘循环分解水制氢主要涉及下列反应:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 把2 mol/L盐酸换成2 mol/L H2SO4 | B. | 碾碎碳酸钙 | ||
| C. | 适当加热 | D. | 增大盐酸的浓度 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向米汤中加入含碘的食盐,观察是否有颜色的变化--检验含碘食盐中是否含碘酸钾 | |
| B. | 向淀粉溶液中加入稀硫酸,加热,再用NaOH中和,并做银镜反应实验--检验淀粉是否水解 | |
| C. | 向甲酸和甲醛的混合物中加入氢氧化钠溶液中和甲酸后,加入新制的氢氧化铜,加热--检验混合物中是否含有甲醛 | |
| D. | 向混有少量乙酸和乙醇杂质的乙酸乙酯中,加入氢氧化钠溶液,然后分液--提纯乙酸乙酯 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
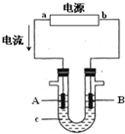 电解原理在化学工业中有广泛应用.右图表示一个电解池,装有电解液c;A、B是两块电极板,通过导线与直流电源相连.
电解原理在化学工业中有广泛应用.右图表示一个电解池,装有电解液c;A、B是两块电极板,通过导线与直流电源相连.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com