
【题目】在体积为2 L的恒容密闭容器中发生反应xA(g)+yB(g) ![]() zC(g),图①表示200 ℃时容器中A、B、C的物质的量随时间的变化,图②表示不同温度下平衡时C的体积分数随起始n(A)∶n(B)的变化关系。则下列结论正确的是 ( )
zC(g),图①表示200 ℃时容器中A、B、C的物质的量随时间的变化,图②表示不同温度下平衡时C的体积分数随起始n(A)∶n(B)的变化关系。则下列结论正确的是 ( )
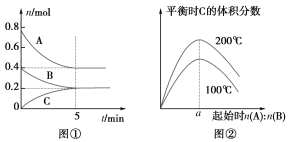
A. 200 ℃时,反应从开始到平衡的平均速率v(B)=0.04 mol·L-1·min-1
B. 由图②知反应xA(g)+yB(g) ![]() zC(g)的ΔH>0,且a=2
zC(g)的ΔH>0,且a=2
C. 若在图①所示的平衡状态下,再向体系中充入He,重新达到平衡前v(正)>v(逆)
D. 200 ℃,6 min时向容器中充入2 mol A和1 mol B,重新达到平衡时,A的体积分数大于0.5
【答案】B
【解析】
A. 根据![]() =
= ![]() =
= ![]() 计算B的反应速率;
计算B的反应速率;
B. 由图②可知,n(A):n(B)一定时,温度越高平衡时C的体积分数越大,说明升高温度平衡向正反应方向移动,据此判断反应热效应;在一定的温度下A、B起始物质的量之比刚好等于平衡时化学方程式的计量数之比,则平衡时生成物C的体积分数最大,由图①判断200℃ A、B的起始物质的量,据此计算a的值;
C. 恒温恒容条件下,通入氦气反应混合物的浓度不变,平衡不移动;
D. 200℃时,向容器中充入2 mol A和1 mol B达到平衡时,等效为原平衡增大压强,根据图①中A、B、C的物质的量变化量之比等于化学计量数之比确定x、y、z,据此判断增大压强对该平衡的影响效果,得出A的体积分数2变化情况。
A.由图①可知,200℃时5 min达到平衡,平衡时B的物质的量变化量为0.4 mol-0.2 mol = 0.2 mol,故![]() (B)=
(B)= ![]() = 0.02 molL-1min-1,故A项错误;
= 0.02 molL-1min-1,故A项错误;
B.由图②可知,n(A):n(B)一定时,温度越高平衡时C的体积分数越大,说明升高温度平衡向正反应移动,升高温度平衡向吸热反应移动,故正反应为吸热反应,即△H>0,图①可知,200℃时平衡时,A的物质的量变化量为0.8 mol-0.4 mol=0.4 mol,B的物质的量变化量为0.2 mol,在一定的温度下只要A、B起始物质的量之比刚好等于平衡化学方程式化学计量数之比,平衡时生成物C的体积分数就最大,A、B的起始物质的量之比 = 0.4 mol:0.2 mol = a = 2,故B项正确;
C.恒温恒容条件下,通入氦气反应混合物的浓度不变,平衡不移动,故v(正)=v(逆),故C项错误;
D.由图①可知,200℃时平衡时,A、B、C的物质的量变化量分别为0.4 mol、0.2 mol、0.2 mol,因各物质的物质的量之比等于化学计量数之比,故x:y:z = 0.4mol:0.2mol:0.2mol = 2:1:1,平衡时A的体积分数为![]() = 0.5,200℃时,向容器中充入2 mol A和1 mol B达到平衡等效为原平衡增大压强,平衡向正反应移动,A的物质的量减小,则达到平衡时,A的体积分数小于0.5,故D项错误;
= 0.5,200℃时,向容器中充入2 mol A和1 mol B达到平衡等效为原平衡增大压强,平衡向正反应移动,A的物质的量减小,则达到平衡时,A的体积分数小于0.5,故D项错误;
答案选B。


 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案科目:高中化学 来源: 题型:
【题目】20mL0.1000mol·L-1氨水用0.1000mol·L-1的盐酸滴定,滴定曲线如图,下列说法正确的是( )
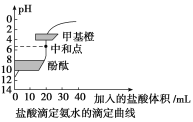
A.该中和滴定适宜用酚酞作指示剂
B.两者恰好中和时,溶液的pH=7
C.达到滴定终点时,溶液中:c(H+)=c(OH-)+c(NH3·H2O)
D.当滴入盐酸达30 mL时,溶液中c(NH4+)+c(H+)<c(OH-)+c(Cl-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化还原反应原理在生产生活和科学研究中应用广泛。
(1)下列表述中没有氧化还原反应发生的是________。
a.滴水成冰 b.蜡炬成灰 c.百炼成钢
(2)NH3和Cl2反应的方程式为: NH3+ Cl2—N2+ HCl
①该反应中被氧化的元素是________(填元素名称),氧化剂是______(填化学式)。
②配平该方程式:NH3 + Cl2 — N2 + HCl __
③工业生产中常用喷洒氨水的方法来检查是否有Cl2泄漏,若Cl2有泄漏,可以观察到的现象是________,产生该现象的反应方程式为________。
(3)“地康法”制氯气的反应原理图示如下:

①反应I的化学方程式为________。
②反应II属于________反应。(填四种基本反应类型之一)。
③若要制得标准状况下氯气11.2L,则整个反应中转移电子的物质的量为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将有机物完全燃烧,生成CO2和H2O,将12 g该有机物完全燃烧产物通过浓硫酸,浓硫酸增重14.4 g,再通过碱石灰,又增重26.4 g。则该有机物的分子式为( )
A. C4H10 B. C2H6O
C. C3H8O D. C2H4O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在1 200 ℃时,天然气脱硫工艺中会发生下列反应
H2S(g)+3/2O2(g)===SO2(g)+H2O(g) ΔH1 ①
2H2S(g)+SO2(g)==3/2S2(g)+2H2O(g) ΔH2 ②
H2S(g)+1/2O2(g)===S(g)+H2O(g) ΔH3 ③
2S(g)===S2(g) ΔH4
则ΔH4的正确表达式为( )
A. ΔH4=2/3(ΔH1+ΔH2-3ΔH3) B. ΔH4=2/3(3ΔH3-ΔH1-ΔH2)
C. ΔH4=2/3(ΔH1+ΔH2-2ΔH3) D. ΔH4=2/3(ΔH1-ΔH2-3ΔH3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.某实验小组为探究ClO-、I2、SO![]() 在酸性条件下的氧化性强弱,设计实验如下:
在酸性条件下的氧化性强弱,设计实验如下:
实验①:在淀粉-碘化钾溶液中加入少量次氯酸钠溶液,并加入少量的稀硫酸,溶液立即变蓝;
实验②:向实验①的溶液中加入4 mL 0.5 mol·L-1的亚硫酸钠溶液,蓝色恰好完全褪去。
(1)写出实验①中发生反应的离子方程式:__________________________。
(2)实验②的化学反应中转移电子的物质的量是___________________。
(3)以上实验说明,在酸性条件下ClO-、I2、SO![]() 的氧化性由弱到强的顺序是________________。
的氧化性由弱到强的顺序是________________。
Ⅱ.(4)Cl2、H2O2、ClO2(还原产物为Cl-)、O3(1 mol O3转化为1 mol O2和1 mol H2O)等物质常被用作消毒剂。等物质的量的上述物质消毒效率最高的是________(填序号)。
A.Cl2 B.H2O2
C.ClO2 D.O3
(5)“84”消毒液(主要成分是NaClO)和洁厕剂(主要成分是浓盐酸)不能混用,原因是_______________________(用离子方程式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式的书写及评价均合理的是( )
选项 | 离子方程式 | 评价 |
A | 将2 mol Cl2通入含1 mol FeI2的溶液中: 2Fe2++2I-+2Cl2===2Fe3++4Cl-+I2 | 正确;Cl2过量,可将Fe2+、I-均氧化 |
B | Ba(HCO3)2溶液与足量的NaOH溶液反应: Ba2++HCO3-+OH-===BaCO3↓+H2O | 正确;酸式盐与碱反应生成正盐和水 |
C | 过量SO2通入NaClO溶液中: SO2+H2O+ClO-===HClO+HSO3- | 正确;说明酸性:H2SO3强于HClO |
D | 1 mol/L的NaAlO2溶液和2.5 mol/L的HCl溶液等体积混合: 2AlO2-+5H+===Al3++Al(OH)3↓+H2O | 正确;第一步反应和第二步反应消耗的H+的物质的量之比为2∶3 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“低碳”在工业生产中意义重大,充分利用原材料,不排放或减少排放“三废”,不同工厂联合生产等都是很好的“低碳”生产方式。下面是几家工厂利用废气、废液、废渣联合生产化肥硫酸铵的工艺:

请回答下列问题:
(1)操作②为______________________________________________________。
(2)工业合成氨的化学方程式为_____________________。
(3)沉淀池中生成硫酸铵的化学方程式________________________________________。
(4)在实验室中检验氨气的方法是_________________________________。
(5)副产品的化学式为________。该联合生产工艺中可以循环使用的物质是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关Na2CO3 和NaHCO3的说法错误的是
A. 等质量Na2CO3 和NaHCO3分别和足量盐酸反应,相同条件下前者生成CO2少
B. 将石灰水分别加入NaHCO3和Na2CO3中,前者不生成沉淀
C. 相同条件下Na2CO3 比NaHCO3更易溶于水
D. Na2CO3 固体中含少量NaHCO3,可用加热法除去
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com