
| A. | 4种 | B. | 5种 | C. | 6种 | D. | 7种 |
 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 0.4 mol/L | B. | 0.3 mol/L | C. | 0.2 mol/L | D. | 0.1 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
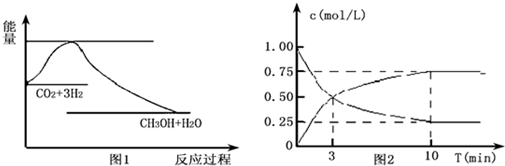
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
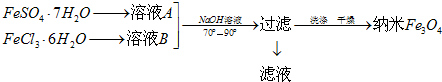
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 明矾是常用的净水剂、具有杀菌、消毒的作用 | |
| B. | BaSO4在医学上用作钡餐,Ba2+对人体无毒 | |
| C. | 考古时,利用14C测定一些文物的年代 | |
| D. | 煤的干馏和石油的分馏都是化学变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 16 | B. | 32 | C. | 64 | D. | 128 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com