

| A. | 8 min时表示正反应速率等于逆反应速率 | |
| B. | 前20 min A的反应速率为0.05 mol•L-1•min-1 | |
| C. | 反应方程式中的x=1,30 min时表示增大压强 | |
| D. | 40 min时改变的条件是升高温度,且正反应为吸热反应 |
分析 A.根据图象可知,20min时反应达到平衡状态,所以8min时平衡向着正向移动;
B.20min时C的浓度为2.0mol/L,则A的浓度变化为1.0mol/L,反应速率为0.05mol/(L•min );
C.30min时正逆反应速率都减小,不可能是增大压强;由于正逆反应速率同时减小,且化学平衡不移动,减小了压强,故x=1;
D.40min时正逆反应速率同时增大,且逆反应速率大于正反应速率.
解答 解:A.0~20min内,反应物B的浓度逐渐减小,生成物C的浓度逐渐增加,说明该时间段反应向着正向移动,正反应速率大于逆反应速率,所以8min时没有达到平衡状态,故A错误;
B.20min时C的浓度变化为2.00mol/L,根据化学计量数关系可知,A的浓度变化为1.00mol/L,所以v(A)=$\frac{1.00mol/L}{20min}$=0.05mol/(L•min ),故B正确;
C.增大压强,正逆反应速率应该都增大,30min时正逆反应速率都减小,不可能增大了压强;由于改变条件,化学平衡不移动,说明是减小了压强,且x=1,故C错误;
D.根据图象可知,40min时正逆反应速率都增大,由于该反应是体积不变的反应,所以不可能增大压强,只能是升高了温度;由于升高温度后,逆反应速率大于正反应速率,说明该反应为放热反应,故D错误;
故选B.
点评 本题考查化学平衡图象,注意图象中反应速率的变化及平衡移动,明确温度、浓度、压强对反应速率及平衡的影响即可解答,题目难度中等.


科目:高中化学 来源: 题型:解答题
 ③
③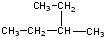 ④
④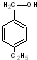 ⑤
⑤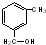 ⑥
⑥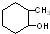
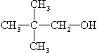 .
.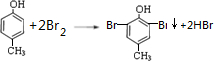 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 物质 | Cl2 | Br2 | I2 | HCl | HBr | HI | H2 |
| 能量(kJ) | 243 | 193 | 151 | 432 | 366 | 298 | 436 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 已知常温下E为无色无味的液体,F为淡黄色粉末,G为常见的无色气体(反应条件均已略去),请回答下列问题:
已知常温下E为无色无味的液体,F为淡黄色粉末,G为常见的无色气体(反应条件均已略去),请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某化学兴趣小组利用如图装置验证元素非金属性的变化规律.
某化学兴趣小组利用如图装置验证元素非金属性的变化规律.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯使酸性KMnO4溶液褪色 | |
| B. | 将苯滴入溴水中,振荡后水层接近无色 | |
| C. | 乙烯使溴的四氯化碳溶液褪色 | |
| D. | 淀粉遇碘水变蓝 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com