
【题目】以乙烯为原料合成化合物C的流程如图所示:

(1)B中含有的官能团名称为___________。
(2)写出A的结构简式:_______________________________。
(3)①、④的反应类型分别为__________反应、__________反应。
(4)写出反应②和④的化学方程式:
②________________________________________________________________;
④________________________________________________________________。
【答案】(1)醛基(1分) (2)ClCH2CH2Cl(1分) (3)加成 酯化(或取代)(2分)
(4)2CH3CH2OH+O2![]() 2CH3CHO+2H2O (2分)
2CH3CHO+2H2O (2分)
2CH3COOH+HOCH2-CH2OH![]() CH3COOCH2-CH2OOCCH3+2H2O(2分)
CH3COOCH2-CH2OOCCH3+2H2O(2分)
【解析】
试题分析:乙烯含有碳碳双键与氯气发生加成反应生成A,A的结构简式为ClCH2CH2Cl,A水解生成乙二醇。乙烯和水发生加成反应生成乙醇,乙醇催化氧化生成乙醛,即B是乙醛。乙醛再氧化生成乙酸,乙酸与乙二醇发生酯化反应生成C,结构简式为CH3COOCH2-CH2OOCCH3。
(1)B是乙醛,其中含有的官能团名称为醛基。
(2)根据以上分析可知A的结构简式为ClCH2CH2Cl。
(3)根据以上分析可知①、④的反应类型分别为加成反应、取代反应。
(4)根据以上分析可知写出反应②和④的化学方程式分别是2CH3CH2OH+O2![]() 2CH3CHO+2H2O、2CH3COOH+HOCH2-CH2OH
2CH3CHO+2H2O、2CH3COOH+HOCH2-CH2OH![]() CH3COOCH2-CH2OOCCH3+2H2O
CH3COOCH2-CH2OOCCH3+2H2O


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】目前工业上有一种方法是用CO2生产燃料甲醇。一定条件下发生反应:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g),该反应的能量变化如图所示:
CH3OH(g)+H2O(g),该反应的能量变化如图所示:
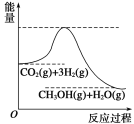
(1)你认为该反应为____________(填放热或吸热)反应.
(2)恒容容器中,对于以上反应,能加快反应速率的是 。
a.升高温度 b.充入He c.加入催化剂 d.降低压强
(3)在体积为2 L的密闭容器中,充入1 mol CO2和3 mol H2,测得CO2的物质的量随时间变化如下表所示。
t/min | 0 | 2 | 5 | 10 | 15 |
n(CO2)/mol | 1 | 0.75 | 0.5 | 0.25 | 0.25 |
从反应开始到5min末,用H2浓度变化表示的平均反应速率v(H2)= ;反应达到平衡状态,此时H2的转化率为 。
(4)在相同温度、容积不变的条件下,能说明该反应已达平衡状态的是 (填序号)。
a.CO2、H2、CH3OH、H2O的浓度均不再变化
b.v生成(CH3OH)=v消耗(CO2)
c.n(CO2)∶n(H2)∶n(CH3OH)∶n(H2O)=1∶1∶1∶1
d.容器中混合气体的密度保持不变
e. H2的消耗速率与CH3OH的消耗速率之比为3∶1
f.体系压强不变
(5)以CH3OH、空气、氢氧化钾溶液为原料,石墨为电极可构成然料电池,该电池中负极上的电极反应式是:_____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电-Fenton法是用于水体里有机污染物降解的高级氧化技术。其反应原理如图所示,其中电解产生的H2O2与Fe2+发生Fenton反应:Fe2++H2O2![]() Fe3++OH- +·OH,生成的羟基自由基(·OH)能氧化降解有机污染物。下列说法不正确的是
Fe3++OH- +·OH,生成的羟基自由基(·OH)能氧化降解有机污染物。下列说法不正确的是
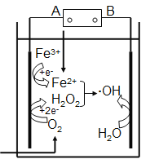
A.电源的A极是负极
B.电解池中只有O2、Fe3+发生还原反应
C.阳极上发生电极反应:H2O-e-![]() ·OH + H+
·OH + H+
D.消耗1molO2,可以产生4mol ·OH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验式相同,但既不是同系物,又不是同分异构体的是 ( )
A.1-戊烯和2-甲基丙烯
B.甲醛和甲酸甲酯
C.1-丁醇与甲醚
D.丙酸和甲酸乙酯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 化学与生活密切相关。下列说法正确的是( )
A. 福尔马林可作食品的保鲜剂
B. 乙烯可作水果的催熟剂
C. 做衣服的棉和麻均与淀粉互为同分异构体
D. 磨豆浆的大豆富含蛋白质,豆浆煮沸后蛋白质变成了氨基酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随原子序数的递增,八种短周期元素(用字母X表示)原子半径的相对大小、最高正价或最低负价的变化如下图所示。

根据判断出的元素回答问题:
(1)d在元素周期表的位置是__________。
(2)d、e、f常见简单离子的半径由大到小为___________(用化学式表示,下同);y、f、g、h的最高价氧化物对应的水化物的酸性由强到弱是:______________________________。
(3)用电子式表示由x和g两种元素形成的化合物的形成过程____________________。由x、y、d三种元素形成的相对分子质量最小的化合物可作为燃料电池的燃料,以KOH溶液为电解质溶液,写出负极反应式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】多沙唑嗪盐酸盐是一种用于治疗高血压的药物。多沙唑嗪的合成路线如下:
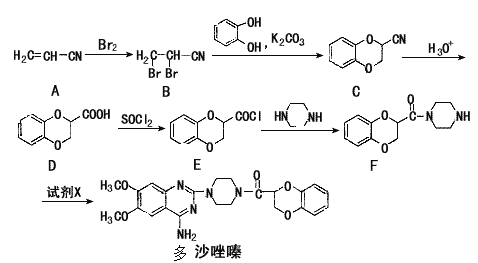
(1)写出D中两种含氧官能团的名称:______和_____。
(2)写出满足下列条件的D的两种同分异构体的结构简式_______________________。
①苯的衍生物,且苯环上的一取代产物只有两种;②与Na2CO3溶液反应放出气体;
③水解后的产物才能与FeCl3溶液发生显色反应。
(3)E→F的反应中还可能生成一种有机副产物,该副产物的结构简式为____________。
(4)由F制备多沙唑嗪的反应中要加入试剂X(C10H10N3O2Cl),X的结构简式为_______。
(5)苯乙酸乙酯是一种常见的合成香料。请设计合理的方案以苯甲醛和乙醇为原料合成
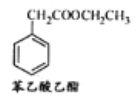
苯乙酸乙酯(用合成路线流程图表示,并注明反应条件)。
提示:①R-Br+Na→R-CN+NaBr;
②合成过程中无机试剂任选;
③合成路线流程图示例如下:
CH3CH2OH ![]() H2C=CH2
H2C=CH2![]() BrH2C-CH2Br
BrH2C-CH2Br
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NH3经一系列反应可以得到HNO3和NH4NO3,如下图所示。
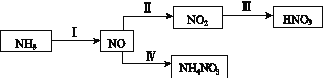
(1)Ⅰ中,NH3和O2在催化剂作用下反应,其化学方程式是______________。
(2)Ⅱ中,2NO(g)+O2(g)![]() 2NO2(g)。在其他条件相
2NO2(g)。在其他条件相
同时,分别测得NO的平衡转化率在不同压强(p1、p2)下随温度变化的曲线(如图)。
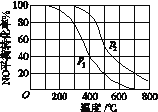
①比较p1、p2的大小关系:p1________p2(填“<”,“>”或“=”)
②随温度升高,该反应平衡常数变化的趋势是________(填“增大”,“减小”或“不变”)。
(3)Ⅲ中,降低温度,将NO2(g)转化为N2O4(l),再制备浓硝酸。
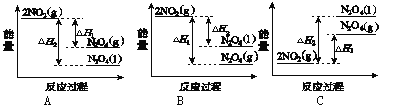
①已知:2NO2(g)![]() N2O4(g) ΔH12NO2(g)
N2O4(g) ΔH12NO2(g)![]() N2O4(l) ΔH2
N2O4(l) ΔH2
下列能量变化示意图中,正确的是(选填字母)________。
②N2O4与O2、H2O化合的化学方程式是____________________。
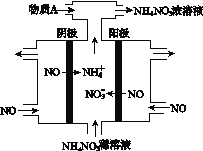
(4)Ⅳ中,电解NO制备NH4NO3,其工作原理如图所示。为使电解产物全部转化为NH4NO3,需补充A。A是______,说明理由:__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作或记录正确的是
A. 常温常压下测得1 mol N2的质量为28 g
B. 用量筒测得排水法收集制得的氢气的体积为50.28 mL
C. 用两只250 mL的容量瓶配制0.1 mol·L-1500 mL的NaOH溶液
D. 用托盘天平称得2.50 g胆矾,受热充分失水后,固体质量减轻0.90 g
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com