
ЎѕМвДїЎїIЈ®ДіОВ¶ИПВЈ¬Kw = 10Ј12ЎЈ
ЈЁ1Ј©Иф±ЈіЦОВ¶ИІ»±дЈ¬ПтЙЩБїЛ®ЦРјУИл_________gµДNaOH№ММеЈ¬ІўјУЛ®ЦБ1 LЈ¬ІЕДЬК№ИЬТєЦРЛ®µзАлІъЙъµДH+ЎўOHЈµДЕЁ¶ИіЛ»эјґЈєc(H+)Ў¤c(OHЈ) = 10Ј22
ЈЁ2Ј©Иф±ЈіЦОВ¶ИІ»±дЈ¬ДіИЬТєЦРc(H+)ОЄ1ЎБ10Ј7 mol/LЈ¬ФтёГИЬТєПФ________РФЈЁСЎМоЎ°ЛбЎ±ЎўЎ°јоЎ±»тЎ°ЦРЎ±Ј©ЎЈ
IIЈ®ЈЁ3Ј©КµСйКТЦРіЈУГNaOHЅшРРПґЖшєНМбґїЈ¬µ±600 mL 1 mol/L NaOHИЬТєОьКХ±кЧјЧґїцПВ8.96 L CO2ЖшМеК±ЛщµГИЬТєЦРёчАлЧУЕЁ¶ИУЙґуµЅРЎµДЛіРтКЗ ЎЈ
ЈЁ4Ј©ТСЦЄіЈОВПВKw[Fe(OH)3] = 4.0ЎБ10Ј38Ј¬ФЪFeCl3ИЬТєЦРјУИлNaHCO3ИЬТєЈ¬·ўЙъ·ґУ¦µДАлЧУ·ЅіМКЅОЄ_____________ЎЈИфЛщµГРьЧЗТєµДpHµчХыОЄ4Ј¬ФтИЬТєЦРFe3+µДЕЁ¶ИОЄ__________mol/LЎЈ
ЈЁ5Ј©КФАыУГЖЅєвТЖ¶ЇФАнЅвКНПВБРКВКµЈєFeSІ»ИЬУЪЛ®Ј¬µ«ДЬИЬУЪПЎСОЛбЦР_________________ЎЈ
Ўѕґр°ёЎїIЈ®ЈЁ1Ј©4ЈЁ2Ј©јо
IIЈ®ЈЁ3Ј©c(Na+)>c(HCO3Ј)>c(CO32Ј)>c(OHЈ)>c(H+)
ЈЁ4Ј©Fe3++3HCO3Ј=Fe(OH)3Ўэ+3CO2Ўь 4.0ЎБ10Ј8
ЈЁ5Ј©FeS(s)![]() Fe2+(aq)+S2Ј(aq)Ј¬јУИлПЎСОЛбєуЈ¬S2Ј+2H+=H2SЎьЈ¬ЖЖ»µБЛFeSµДИЬЅвЖЅєвЈ¬К№ЙПКцЖЅєвПтFeSИЬЅвµД·ЅПтТЖ¶ЇЈ¬№КFeSИЬЅвЎЈ
Fe2+(aq)+S2Ј(aq)Ј¬јУИлПЎСОЛбєуЈ¬S2Ј+2H+=H2SЎьЈ¬ЖЖ»µБЛFeSµДИЬЅвЖЅєвЈ¬К№ЙПКцЖЅєвПтFeSИЬЅвµД·ЅПтТЖ¶ЇЈ¬№КFeSИЬЅвЎЈ
ЎѕЅвОцЎї
КФМв·ЦОцЈєЈЁ1Ј©УЙЛ®µДµзАл·ЅіМКЅїЙЦЄЈ¬Л®µзАліцµДc(H+)µИУЪЛ®µзАліцµДc(OHЈ)Ј» УЙµзАлІъЙъµДH+ЎўOHЈµДЕЁ¶ИіЛ»э = c(H+)Ў¤c(OHЈ) = 10Ј22їЙЦЄЈ¬Л®µзАліцµДc(H+) = Л®µзАліцµДc(OHЈ) = 1ЎБ10Ј11 mol/LЈ»УЙУЪNaOHКЗЗїµзЅвЦКЈ¬H2OКЗј«ИхµзЅвЦКЈ¬ТтґЛNaOHµзАліцµДc(OHЈ) = c(NaOH) >>Л®µзАліцµДc(OHЈ)Ј¬ФтИЬТєЦРµДc(OHЈ) ЅьЛЖµИУЪ c(NaOH)Ј¬¶шИЬТєЦРµДc(H+) = Л®µзАліцµДc(H+)Ј¬УЙKw = 10Ј12 = c(H+)Ў¤c(OHЈ)Ј¬c(OHЈ) = 1ЎБ10Ј1 mol/LЈ¬Фтc(NaOH) = 1ЎБ10Ј1 mol/L = 0.1 mol/LЈ»УЙ![]() ЎўПЎИЬТєµДМе»эФјµИУЪЛ®µДМе»эЎў
ЎўПЎИЬТєµДМе»эФјµИУЪЛ®µДМе»эЎў![]() їЙЦЄЈ¬ c(NaOH) = 0.1 mol/L =
їЙЦЄЈ¬ c(NaOH) = 0.1 mol/L =  Ј¬Фтm = 4 gЈ»ЈЁ2Ј©Иф±ЈіЦОВ¶ИІ»±дЈ¬ДіИЬТєЦРc(H+)ОЄ1ЎБ10Ј7 mol/LЈ¬УЙKw = 10Ј12 = c(H+)Ў¤c(OHЈ)їЙЦЄЈ¬c(OHЈ) = 1ЎБ10Ј5 mol/LЈ¬1ЎБ10Ј5 > 1ЎБ10Ј7Ј¬јґИЬТєЦРµДc(H+)РЎУЪc(OHЈ)Ј¬ТтґЛёГИЬТєПФјоРФЈ»ЈЁ3Ј©ПИУЙcVЎў
Ј¬Фтm = 4 gЈ»ЈЁ2Ј©Иф±ЈіЦОВ¶ИІ»±дЈ¬ДіИЬТєЦРc(H+)ОЄ1ЎБ10Ј7 mol/LЈ¬УЙKw = 10Ј12 = c(H+)Ў¤c(OHЈ)їЙЦЄЈ¬c(OHЈ) = 1ЎБ10Ј5 mol/LЈ¬1ЎБ10Ј5 > 1ЎБ10Ј7Ј¬јґИЬТєЦРµДc(H+)РЎУЪc(OHЈ)Ј¬ТтґЛёГИЬТєПФјоРФЈ»ЈЁ3Ј©ПИУЙcVЎў![]() їЙЦЄЈ¬NaOHЎўCO2µДn·Ц±рОЄ0.6 molЎў0.4molЈ»ЙиNaOHµДПµКэОЄ6Ј¬УЙЗвЎўФЧУёцКэКШєгЕдЖЅїЙµГЈє6 NaOH + 4 CO2 = 2 Na2CO3 + 2 NaHCO3 + 2 H2OЈ¬ЛµГчЛщµГИЬТєЦРNa2CO3Ўў NaHCO3µДЕЁ¶ИПаµИЈЁѕщФјОЄ0.33mol/LЈ©Ј¬БЅИЬЦК¶јКЗЗїµзЅвЦКЎўЗїјоИхЛбСОЈ¬ТтґЛc(Na+)ЧоґуЈ»УЙУЪЛбРФЈєH2CO3 > HCO3ЈЈ¬ТтґЛ¶юХЯ¶ФУ¦СОЈЁNaHCO3ЎўNa2CO3Ј©µДЛ®ЅвіМ¶ИЈєHCO3Ј < CO32ЈЈ¬ТтґЛґпµЅЖЅєвК±ИЬТєКЈУаµД c(HCO3Ј) > c(CO32Ј)Ј»УЙУЪЛ®ЅвіМ¶ИЅПИхЈ¬ТтґЛЛ®ЅвЙъіЙµДc(OHЈ) < c(CO32Ј)Ј»ЗїјоИхЛбСОЛ®Ѕв»бПыєДЛ®µзАліцµДЗвАлЧУЈ¬ЖдИЬТєіКИхјоРФЈ¬ТтґЛЖЅєвК±ИЬТєЦРc(H+)ЧоРЎЈ»ЈЁ4Ј©FeCl3КЗЗїЛбИхјоСОЈ¬NaHCO3КЗЗїјоИхЛбСОЈ¬¶юХЯДЬ·ўЙъЛ«Л®Ѕв·ґУ¦Ј¬ЙъіЙЗвСх»ЇМъіБµнєН¶юСх»ЇМјЖшМеЈ¬УЙЙи1·ЁЕдЖЅїЙµГЈєFe3+ + 3 HCO3Ј = Fe(OH)3Ўэ + 3 CO2ЎьЈ»ИфЛщµГРьЧЗТєµДpHµчХыОЄ4Ј¬ФтёГИЬТєЦРµДc(H+) = 1ЎБ10Ј4 mol/LЈ»УЙіЈОВПВKw = 10Ј14 = c(H+)Ў¤c(OHЈ)Ј¬c(OHЈ) = 1ЎБ10Ј10 mol/LЈ»УЙFe(OH)3
їЙЦЄЈ¬NaOHЎўCO2µДn·Ц±рОЄ0.6 molЎў0.4molЈ»ЙиNaOHµДПµКэОЄ6Ј¬УЙЗвЎўФЧУёцКэКШєгЕдЖЅїЙµГЈє6 NaOH + 4 CO2 = 2 Na2CO3 + 2 NaHCO3 + 2 H2OЈ¬ЛµГчЛщµГИЬТєЦРNa2CO3Ўў NaHCO3µДЕЁ¶ИПаµИЈЁѕщФјОЄ0.33mol/LЈ©Ј¬БЅИЬЦК¶јКЗЗїµзЅвЦКЎўЗїјоИхЛбСОЈ¬ТтґЛc(Na+)ЧоґуЈ»УЙУЪЛбРФЈєH2CO3 > HCO3ЈЈ¬ТтґЛ¶юХЯ¶ФУ¦СОЈЁNaHCO3ЎўNa2CO3Ј©µДЛ®ЅвіМ¶ИЈєHCO3Ј < CO32ЈЈ¬ТтґЛґпµЅЖЅєвК±ИЬТєКЈУаµД c(HCO3Ј) > c(CO32Ј)Ј»УЙУЪЛ®ЅвіМ¶ИЅПИхЈ¬ТтґЛЛ®ЅвЙъіЙµДc(OHЈ) < c(CO32Ј)Ј»ЗїјоИхЛбСОЛ®Ѕв»бПыєДЛ®µзАліцµДЗвАлЧУЈ¬ЖдИЬТєіКИхјоРФЈ¬ТтґЛЖЅєвК±ИЬТєЦРc(H+)ЧоРЎЈ»ЈЁ4Ј©FeCl3КЗЗїЛбИхјоСОЈ¬NaHCO3КЗЗїјоИхЛбСОЈ¬¶юХЯДЬ·ўЙъЛ«Л®Ѕв·ґУ¦Ј¬ЙъіЙЗвСх»ЇМъіБµнєН¶юСх»ЇМјЖшМеЈ¬УЙЙи1·ЁЕдЖЅїЙµГЈєFe3+ + 3 HCO3Ј = Fe(OH)3Ўэ + 3 CO2ЎьЈ»ИфЛщµГРьЧЗТєµДpHµчХыОЄ4Ј¬ФтёГИЬТєЦРµДc(H+) = 1ЎБ10Ј4 mol/LЈ»УЙіЈОВПВKw = 10Ј14 = c(H+)Ў¤c(OHЈ)Ј¬c(OHЈ) = 1ЎБ10Ј10 mol/LЈ»УЙFe(OH)3 ![]() Fe3+ + 3OHЈїЙЦЄЈ¬Kw[Fe(OH)3] = 4.0ЎБ10Ј38 = c(Fe3+) c3(OHЈ)Ј¬Фтc(Fe3+) =
Fe3+ + 3OHЈїЙЦЄЈ¬Kw[Fe(OH)3] = 4.0ЎБ10Ј38 = c(Fe3+) c3(OHЈ)Ј¬Фтc(Fe3+) = ![]() mol/L = 4.0ЎБ10Ј8 mol/LЈ»ЈЁ5Ј©FeS(s)
mol/L = 4.0ЎБ10Ј8 mol/LЈ»ЈЁ5Ј©FeS(s)![]() Fe2+(aq) + S2Ј(aq)Ј¬јУИлПЎСОЛбєуЈ¬S2Ј + 2 H+ = H2SЎьЈ¬ЖЖ»µБЛFeSµДИЬЅвЖЅєвЈ¬К№ЙПКцЖЅєвПтFeSИЬЅвµД·ЅПтТЖ¶ЇЈ¬№КFeSДСИЬУЪЛ®Ј¬µ«ТЧИЬУЪСОЛбЎЈ
Fe2+(aq) + S2Ј(aq)Ј¬јУИлПЎСОЛбєуЈ¬S2Ј + 2 H+ = H2SЎьЈ¬ЖЖ»µБЛFeSµДИЬЅвЖЅєвЈ¬К№ЙПКцЖЅєвПтFeSИЬЅвµД·ЅПтТЖ¶ЇЈ¬№КFeSДСИЬУЪЛ®Ј¬µ«ТЧИЬУЪСОЛбЎЈ



| Дкј¶ | ёЯЦРїОіМ | Дкј¶ | іхЦРїОіМ |
| ёЯТ» | ёЯТ»Гв·СїОіМНЖјцЈЎ | іхТ» | іхТ»Гв·СїОіМНЖјцЈЎ |
| ёЯ¶ю | ёЯ¶юГв·СїОіМНЖјцЈЎ | іх¶ю | іх¶юГв·СїОіМНЖјцЈЎ |
| ёЯИэ | ёЯИэГв·СїОіМНЖјцЈЎ | іхИэ | іхИэГв·СїОіМНЖјцЈЎ |
їЖДїЈєёЯЦР»ЇС§ АґФґЈє МвРНЈє
ЎѕМвДїЎїПВБР»ЇС§КµСйІЩЧч»тКВ№Кґ¦Ан·Ѕ·ЁІ»ХэИ·µДКЗЈЁ Ј©
A. І»ЙчЅ«ЛбЅ¦µЅСЫЦРЈ¬У¦БўјґУГЛ®іеПґЈ¬±ЯПґ±ЯХЈСЫѕ¦
B. І»ЙчЅ«ЕЁјоИЬТєХґµЅЖ¤·фЙПЈ¬ТЄБўјґУГґуБїЛ®іеПґЈ¬И»єуНїЙПЕрЛб
C. ѕЖѕ«µЖЧЕ»рК±їЙУГКЄДЁІјЖЛГр
D. ЕдЦЖБтЛбИЬТєК±Ј¬їЙПИФЪБїНІЦРјУИлТ»¶ЁМе»эµДЛ®Ј¬ФЩФЪЅБ°иМхјюПВВэВэјУИлЕЁБтЛб
Ійїґґр°ёєНЅвОц>>
їЖДїЈєёЯЦР»ЇС§ АґФґЈє МвРНЈє
ЎѕМвДїЎїѕЭЎ¶ІОїјПыПўЎ·±ЁµАЈ¬УРїЖС§јТМбіц№иКЗЎ°21КАјНµДДЬФґЎ±ЎўЎ°ОґАґµДКЇУНЎ±µД№ЫµгЎЈ
ЈЁ1Ј©ѕ§Ме№иФЪСхЖшЦРИјЙХµДИИ»ЇС§·ЅіМКЅОЄSiЈЁsЈ©+ O2ЈЁgЈ©ЁT SiO2ЈЁsЈ© ¦¤H = Ј989.2 kJmolЈ1Ј¬УР№ШјьДЬКэѕЭИзПВ±нЈє
»ЇС§јь | Si-O | OЁTO | Si-Si |
јьДЬ / kJmolЈ1 | x | 498.8 | 176 |
ТСЦЄ1 mol SiЦРє¬2 mol Si-SiјьЈ¬1 mol SiO2ЦРє¬4 mol Si-OјьЈ¬ФтxµДЦµОЄ__________ЎЈ
ЈЁ2Ј©јЩИз№иЧчОЄТ»ЦЦЖХ±йК№УГµДРВРНДЬФґ±»їЄ·ўАыУГЈ¬№ШУЪЖдУРАыТтЛШµДПВБРЛµ·ЁЦРЈ¬ДгИПОЄІ»НЧµ±µДКЗ______________ЎЈ
AЈ®№и±гУЪФЛКдЎўЦьґжЈ¬ґУ°ІИ«ЅЗ¶ИїјВЗЈ¬№иКЗЧојСµДИјБП
BЈ®№иµДАґФґ·бё»Ј¬ТЧУЪїЄІЙЈ¬ЗТїЙФЩЙъ
CЈ®№иИјЙХ·ЕіцµДИИБїґуЈ¬ЗТИјЙХІъОп¶Ф»·ѕіОЫИѕіМ¶ИµНЈ¬ИЭТЧУРР§їШЦЖ
DЈ®С°ХТёЯР§РВґЯ»ЇјБЈ¬їЙТФК№·ґУ¦SiO2 + 2 C![]() Si + 2 CO ЎьФЪіЈОВПВ·ўЙъЈ¬КЗ№иДЬФґїЄ·ўАыУГµД№ШјьјјКх
Si + 2 CO ЎьФЪіЈОВПВ·ўЙъЈ¬КЗ№иДЬФґїЄ·ўАыУГµД№ШјьјјКх
ЈЁ3Ј©№¤ТµЦЖ±ёґї№иµД·ґУ¦ОЄ2 H2ЈЁgЈ©+ SiCl4ЈЁgЈ©ЁT SiЈЁsЈ©+ 4 HClЈЁgЈ© ¦¤H = + 240.4 kJmolЈ1Ј¬ЙъіЙµДHClНЁИл100 mL 1 molLЈ1µДNaOHИЬТєЗЎєГНкИ«±»ОьКХЈ¬ФтЙПКцЦЖ±ёґї№иµД·ґУ¦№эіМЦР__________ЈЁМоЎ°ОьКХЎ±»тЎ°КН·ЕЎ±Ј©µДИИБїОЄ__________kJЎЈ
Ійїґґр°ёєНЅвОц>>
їЖДїЈєёЯЦР»ЇС§ АґФґЈє МвРНЈє
ЎѕМвДїЎїТСЦЄТ»¶ЁОВ¶ИС№ЗїПВЈ¬N2(g) + 3H2(g)![]() 2 NH3(g) ¦¤H = Ј92 kJ/molЈ¬ФЪН¬ОВПВПтДі¶ЁИЭГЬ±ХИЭЖчјЧЦРНЁИл1.0 mol N2єН3.0 mol H2Ј¬·ґУ¦НкіЙК±·ЕіцИИБїQ1 kJЈ¬ПтБнТ»Ме»эПаН¬µД¶ЁИЭГЬ±ХИЭЖчТТЦРНЁИл1.5 mol N2єН3.0 mol H2Ј¬ПаН¬МхјюПВ·ґУ¦НкіЙК±·ЕіцИИБїОЄQ2 kJЈ¬ФтПВБР№ШПµХэИ·µДКЗЈЁ Ј©
2 NH3(g) ¦¤H = Ј92 kJ/molЈ¬ФЪН¬ОВПВПтДі¶ЁИЭГЬ±ХИЭЖчјЧЦРНЁИл1.0 mol N2єН3.0 mol H2Ј¬·ґУ¦НкіЙК±·ЕіцИИБїQ1 kJЈ¬ПтБнТ»Ме»эПаН¬µД¶ЁИЭГЬ±ХИЭЖчТТЦРНЁИл1.5 mol N2єН3.0 mol H2Ј¬ПаН¬МхјюПВ·ґУ¦НкіЙК±·ЕіцИИБїОЄQ2 kJЈ¬ФтПВБР№ШПµХэИ·µДКЗЈЁ Ј©
AЈ®2 Q2 = Q1 = 92.4 BЈ®Q2 < Q1 < 92.4 CЈ®Q1 = Q2 = 92.4 DЈ®Q1 < Q2 < 92.4
Ійїґґр°ёєНЅвОц>>
їЖДїЈєёЯЦР»ЇС§ АґФґЈє МвРНЈє
ЎѕМвДїЎїПВБРёчЧйФЄЛШЈ¬КфУЪН¬Т»ЦЬЖЪµДТ»ЧйКЗ( )
A. H ЎўLi ЎўNa B. Na ЎўMg ЎўCa
C. Al ЎўP ЎўS D. N ЎўO ЎўCl
Ійїґґр°ёєНЅвОц>>
їЖДїЈєёЯЦР»ЇС§ АґФґЈє МвРНЈє
ЎѕМвДїЎїТТП©µДІъБїїЙУГАґєвБїТ»ёц№ъјТµДКЇУН»Ї№¤·ўХ№Л®ЖЅЎЈПВБР№ШУЪТТП©µДЛµ·ЁХэИ·µДКЗ
A. Ул±Ѕ»ҐОЄН¬·ЦТм№№Ме
B. ·ЦЧУЦРґжФЪМјМјЛ«јь
C. ДЬК№деµДЛДВИ»ЇМјИЬТєНКЙ«
D. ДЬК№ЛбРФёЯГМЛбјШИЬТєНКЙ«
Ійїґґр°ёєНЅвОц>>
їЖДїЈєёЯЦР»ЇС§ АґФґЈє МвРНЈє
ЎѕМвДїЎїДіУР»ъОп·ЦЧУКЅОЄC4H8Ј¬ѕЭґЛНЖІвЖдЅб№№єНРФЦКІ»їЙДЬµДКЗЈЁ Ј©
AЈ®ЛьїЙДЬДЬК№ЛбРФёЯГМЛбјШИЬТєНКЙ«
BЈ®Т»ВИґъОпїЙДЬЦ»УРТ»ЦЦ
CЈ®·ЦЧУЅб№№ЦРјЧ»щµДКэДїїЙДЬКЗ0Ўў1Ўў2
DЈ®µИЦКБїCH4єНC4H8·Ц±рФЪСхЖшЦРНкИ«ИјЙХЈ¬CH4µДєДСхБїРЎУЪC4H8
Ійїґґр°ёєНЅвОц>>
їЖДїЈєёЯЦР»ЇС§ АґФґЈє МвРНЈє
ЎѕМвДїЎї±Ј»¤»·ѕіИХТжТэЖрИЛГЗµДЦШКУЈ®ПВБРЧц·ЁУРАыУЪ±Ј»¤»·ѕіµДКЗЈЁ Ј©
A.ЗвДЬФґґъМж»ЇКЇДЬФґ
B.НЖ№гК№УГМ«СфДЬµзіШ
C.µз¶ЇЖыіµґъМжИјУНЖыіµ
D.ФмЦЅі§ОЫЛ®Ц±ЅУЕЕ·Е
Ійїґґр°ёєНЅвОц>>
їЖДїЈєёЯЦР»ЇС§ АґФґЈє МвРНЈє
ЎѕМвДїЎїПВНјОЄіЈОВПВПт25 mL 0.1 mol/L MOHИЬТєЦРЦрµОµОјУ0.2 mol/L HClИЬТє№эіМЦРИЬТєpHµД±д»ЇЗъПЯЎЈПВБРНЖ¶ПХэИ·µДКЗ
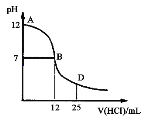
AЈ®MOHФЪЛ®ЦРµДµзАл·ЅіМКЅКЗЈєMOH=NЈ«Ј«OHЈ
BЈ®ФЪBµг±нКѕЛбјоЗЎєГЦРєН
CЈ®AµгЎъDµгЈ¬ИЬТєµДµјµзДЬБ¦ЦрЅҐФцЗї(єцВФМе»э±д»Ї)
DЈ®ФЪDµгК±Ј¬ґжФЪc(HЈ«)Јѕc(OHЈ)Јѕc(ClЈ)Јѕc(MЈ«)
Ійїґґр°ёєНЅвОц>>
°Щ¶ИЦВРЕ - Б·П°ІбБР±н - КФМвБР±н
єю±±КЎ»ҐБЄНшОҐ·ЁєНІ»БјРЕПўѕЩ±ЁЖЅМЁ | НшЙПУРє¦РЕПўѕЩ±ЁЧЁЗш | µзРЕХ©ЖѕЩ±ЁЧЁЗш | ЙжАъК·РйОЮЦчТеУРє¦РЕПўѕЩ±ЁЧЁЗш | ЙжЖуЗЦИЁѕЩ±ЁЧЁЗш
ОҐ·ЁєНІ»БјРЕПўѕЩ±Ёµз»°Јє027-86699610 ѕЩ±ЁУКПдЈє58377363@163.com